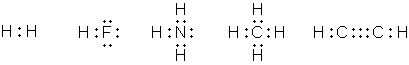|
ЛЬЮИС (Lewis), Джилберт Ньютон 23 октября 1875 г. – 23 марта 1946 г.
В 1904 г. Льюис покинул Гарвардский университет (по некоторым данным, вследствие конфликта с Ричардсом по поводу механизма образования химической связи и электронного строения молекул) и в течение года был руководителем Палаты мер и весов в Маниле, Филиппины. В следующем году он устроился преподавателем в Массачусетский технологический институт (MIT) в Кембридже, где влился в коллектив талантливых физикохимиков под руководством А. А. Нойса, который, как и прежний научный руководитель Льюиса, Ричардс, получил учёную степень в Лейпциге, под руководством В. Оствальда. В 1907 г. Льюис становится доцентом, в 1908 г. – адъюнкт-профессором, в 1911 г. – профессором MIT. В 1908 г. он публикует несколько статей по теории относительности, в которых он другим способом, отличным от способа Альберта Эйнштейна, выводит взаимосвязь массы и энергии. В 1912 г. Льюис переезжает в Беркли, получив должность руководителя химического факультета и декана в Калифорнийском университете (на этой должности он и оставался до конца своей жизни). Научные достижения Льюиса, интересовавшегося очень широким спектром научных проблем, чрезвычайно велики; его называют одним из самых выдающихся американских физикохимиков. В 1907 г. ввёл в теорию реальных растворов понятия «активность ионов» и «коэффициент активности». В 1916 г. Льюис высказал идею, что химическая связь может образовываться за счёт обобществления пары электронов, (т. н. ковалентная связь), в противовес принятой тогда теории, что один из связанных атомов несёт положительный, а другой – отрицательный заряды. Впоследствии эта идея Льюиса была развита нобелевским лауреатом Ирвингом Ленгмюром. Льюис также сформулировал идею, что завершённый внешний электронный слой содержит восемь электронов (хотя никогда не использовал собственно термина «октет»), а также предложил обозначать электроны точками у символа элемента. Его книга «Валентность и структура атомов и молекул» (1923) стала классической.
В 1923 г. он сформулировал также одну из основных современных теорий кислот и оснований – электронную (её второе название – теория Льюиса). Согласно ей, кислота – вещество, принимающее электронные пары, т. е. акцептор электронных пар, а основание – вещество, отдающее электронные пары, т. е. донор электронных пар (такие соединения получили названия соответственно кислот и оснований Льюиса). В 1926 г. Льюис предложил термин фотон для обозначения мельчайшей единицы излучения. В 1933 г. он выделил в чистом виде тяжёлую воду (совместно с Г. К. Юри, своим учеником, который ранее, в 1932 г. обнаружил предсказанные ранее Льюисом отдельные молекулы тяжёловодородной воды в природной воде). Он провёл большое количество исследований тяжёлой воды, дейтрона (ядро атома дейтерия, аналог протона), а также изотопов лития и исследований в нейтронной физике. Льюис совместно с Э. Лоуренсом работал над созданием циклотрона и был одним из первых учёных, проводивших эксперименты по столкновению элементарных частиц. Льюис разработал методы расчёта свободных энергий химических реакций. За время работы в MIT он определил огромное количество термодинамических параметров: энергий Гиббса, стандартных электродных потенциалов, проводимости и других, составив таблицы их значений, которые используются до сих пор. Льюис предложил новую формулировку третьего начала термодинамики, что дало возможность точно определить абсолютную энтропию. В последние годы жизни он интересовался фотохимией, в частности, установил, что люминесценция органических молекул включает возбуждённое триплетное состояние. Он также изучил магнитные свойства триплетного состояния. За то время, когда Льюис был руководителем химического факультета в Беркли, он превратил этот факультет в один из лучших химических факультетов в стране. Он создал настоящую научную школу, среди его учеников двести восемьдесят девять докторов наук и двадцать лауреатов Нобелевской премии. В 1913 г. Льюис стал членом Национальной академии наук в Вашингтоне (однако в 1934 г. прекратил членство в этой организации из-за несогласия с внутренней политикой этой организации). В 1930 г. был награждён медалью Общества искусств и наук как «выдающийся американский химик». С 1942 г. почётный член Академии наук СССР. Более тридцати раз номинировался на Нобелевскую премию. В 1912 г. Льюис женился на Мэри Шелдон, дочери гарвардского профессора. Этот брак принёс ему двоих сыновей (оба они продолжили дело отца, став профессорами-химиками) и дочь. Во время Первой Мировой войны Льюис служил во Франции руководителем подразделения химической защиты, был награждён американской медалью за отличную службу и французским орденом Почётного Легиона. Умер он в своей лаборатории 23 марта 1946 г. от сердечного приступа. 1. Биографии великих химиков. Перевод с нем. под
ред. Быкова Г.В. – М.: Мир, 1981. 320 с.
|
 Американский
физикохимик Джилберт Ньютон Льюис родился
в городке Уэймут, близ Бостона. Окончив школу в
Линкольне, штат Небраска, в
четырнадцатилетнем возрасте Льюис поступил в университет штата Небраска.
Через три года он перевёлся в
Гарвардский университет, который закончил в
1896 г., получив
степень бакалавра наук. В 1898 г. Льюис опубликовал свою первую научную статью, посвящённую термохимическим и
электрохимическим свойствам амальгам.
Диссертацию, выполненную под руководством
Американский
физикохимик Джилберт Ньютон Льюис родился
в городке Уэймут, близ Бостона. Окончив школу в
Линкольне, штат Небраска, в
четырнадцатилетнем возрасте Льюис поступил в университет штата Небраска.
Через три года он перевёлся в
Гарвардский университет, который закончил в
1896 г., получив
степень бакалавра наук. В 1898 г. Льюис опубликовал свою первую научную статью, посвящённую термохимическим и
электрохимическим свойствам амальгам.
Диссертацию, выполненную под руководством