|
Кафедра физической и коллоидной химии ЮФУ Материалы к лекциям для студентов химфака ТЕРМОДИНАМИКА РАСТВОРОВ Образование растворов. Растворимость – Давление пара растворов. Закон Рауля – Состав равновесного пара – Перегонка растворов. Системы 1-го типа – Перегонка растворов. Системы 2-го типа – Температура кристаллизации растворов – Температура кипения растворов. Осмотическое давление – Растворы электролитов Состав равновесного пара над раствором Если рассмотреть, как соотносятся состав раствора и состав равновесного пара, то нетрудно показать, что в общем случае мольная доля компонента в растворе Хi не совпадает с мольной долей компонента в паре Yi.
Подставив сюда уравнение (9), получаем:
Разделив
числитель и знаменатель правой части
уравнения на Р°А
и введя обозначение
Из
уравнения (12) видно, что YB = XB
только при условии, что α
= 1, т.е. при равенстве давлений
насыщенного пара чистых компонентов А и
В. Если α
> 1, то мольная доля компонента В в паре
оказывается больше, чем его мольная доля
в растворе (и наоборот). Вид зависимости
состава равновесного пара от состава
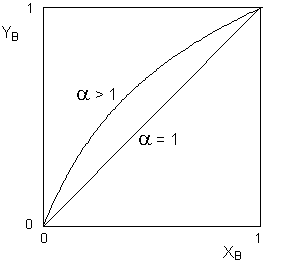
раствора приведён на рисунке 3.
Рис.
3. Зависимость состава пара от
состава раствора для идеальных
растворов. Данную зависимость состава пара от состава раствора качественно описывает первый закон Коновалова: Равновесный пар по сравнению с жидкостью относительно обогащён тем компонентом, добавление которого к жидкости повышает общее давление пара над раствором (или, что то же самое, понижает температуру кипения раствора при некотором постоянном давлении). Первый
закон Коновалова применим как к
идеальным, так и к неидеальным растворам.
Если отклонения от первого закона Рауля
невелики, то зависимость состава пара от
состава раствора имеет вид, аналогичный
изображённому на рисунке 3 для случая,
когда α
> 1. Если отклонения раствора от
идеального велики, на кривой
зависимости общего давления пара от
состава раствора может появиться
экстремум (максимум или минимум для
положительных и отрицательных
отклонений соответственно). В этом
случае зависимость состава пара от
состава раствора имеет более сложный
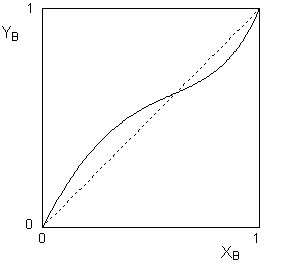
вид, показанный на рисунке 4.
Рис.
4. Зависимость состава пара от
состава раствора для систем, имеющих
экстремум на кривой зависимости общего
давления пара от состава раствора. Аналогичная ситуация может иметь место и для близких к идеальному раствору систем, в которых компоненты раствора имеют близкие температуры кипения (давления насыщенного пара над чистым компонентом). Данная ситуация описывается вторым законом Коновалова: Точки экстремума на кривой зависимости общего давления пара от состава раствора отвечают растворам, состав равновесного пара над которыми совпадает с составом раствора. Такие растворы называются нераздельно кипящими или азеотропными смесями. Законы Коновалова можно вывести термодинамически, воспользовавшись уравнением Дюгема – Моргулиса, связывающим парциальные давления паров компонентов бинарного раствора с их мольными долями в растворе:
Переписав уравнение (13) в виде
и подставив туда XA = 1 – XB, получаем:
Выражая dPA из уравнения (15) и подставляя вместо парциального давления каждого из компонентов произведение общего давления пара на мольную долю компонента в паре (PA = PYA = P(1–YB), PB = PYB), получим:
Учитывая, что, согласно закону Дальтона, dP = dPA + dPB, уравнение (16) можно переписать относительно dP:
Разделив это выражение на dXB, получаем зависимость, связывающую общее давление пара над бинарным раствором с мольной долей компонента B в растворе:
Таким
образом, если добавление в раствор
компонента B увеличивает общее давление
пара ( В
точке экстремума производная давления
по мольной доле B
На различии составов раствора и равновесного с ним пара основано разделение растворов с помощью перегонки. Для рассмотрения равновесия в таких системах удобно пользоваться диаграммами состояния раствор – пар в координатах давление пара – состав или температура кипения – состав. |
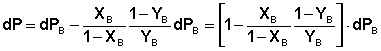 (17)
(17)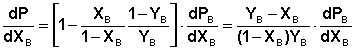 (18)
(18)