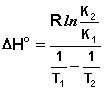|
1. Теоретическая часть
На приборе ИКС-14А максимуму полосы поглощения соответствует определенное число на барабане условных чисел. Для дальнейшей работы со спектрами необходимо эти условные числа перевести в частоты (более точно - в волновые числа - см-1). Поэтому первой задачей при работе на ИКС-14А является построение градуировочных графиков деления барабана - частота в см-1. Такие графики строят отдельно для каждой призмы. Графики должны быть близки к пряной линии. Призма NaCl градуируется по спектру полистирола; призма LiF по полистиролу и хлороформу; призма КBr - по полистиролу и парам воды, содержащийся в атмосфере, В последнем случае запись спектра проходит по так называемой однолучевой схеме. Запись эталонных спектров проводится в тех же условиях, в которых затем будут записываться рабочие спектры. На основании серии пар значений чисел: деления барабана - частота в см-1 строятся на миллиметровой бумаге градуировочные графики. На каждом из них отмечается положение так называемого контрольного пика, который будет затем прописываться перед съемкой каждого рабочего спектра. Например: "контрольный пик полистирола - 5,42 деления барабана". Если при записи контрольного пика его значение более чем на 0,05 деления отличаются от значения, указанного на градуировочном графике, следует проводить новую градуировку. Задание к работе №1. По указанию преподавателя следует провести градуировку барабана для одной из призм (LiF, NaCl, KBr). Форма отчета: эталонные спектры; набор значений пар чисел деления барабана - частота в см-1; градуировочный график на миллиметровой бумаге ориентировочного размера 1,5 м на 1,5 м.
Задание к работе № 2. Требуется по спектру соединения его идентифицировать. Преподаватель дает пронумерованные соединения 1 -5 (C6H5OH, C3H7OH, C6H5NH2, C6H5CH3, C5H5N, HN(C6H5)2, C6H5CHO и др. при работе на призме LiF; CH3COC2H5, C6H5COCl, C6H5COCH3, C6H5COC6H5 и др. при работе на призме NaCl). Преподаватель сообщает также брутто-формулы соединений. 1. Приготовить растворы полученных соединений в CCl4 или другом подходящем растворителе, примерная концентрация 0,005-0,002 моль/л при толщине поглощающего слоя 4-5 мм. Если растворитель сам заметно поглощает в исследуемой области, то концентрацию увеличить в 10 раз, а толщину поглощающего слоя уменьшить до 0,01 - 0,5 мм. Точные значения концентрации и толщину поглощающего слоя находят после съемки 1 - 2 пробных спектров. 2. Записать спектры растворов в выбранном по корреляционным таблицам интервале частот. 3. Произвести отнесение интенсивных полос поглощение по корреляционным таблицам (см. приложение) к тем или иным функциональным группам. Приписать к каждому из пронумерованных соединений определенную структурную формулу. Форма отчета: спектры соединений, частоты основных максимумов поглощения для каждого соединения и их отнесение, а также формула. Например: соединение 1; частота 3610 см-1 - группа ОН в ароматическом кольце. Предполагаемая формула C6H5OH.
Положение полос поглощения замещенных производных бензола весьма специфично для каждого типа замещения. Так дизамещенные производные имеют не перекрывающиеся характерные области поглощения, что позволяет производить количественный анализ содержания изомеров в растворе:
Задание к работе № 3. 1. Приготовить 4-5 % растворы (по объему) каждого изомера ксилола в циклогексане (С = 0,1 м/л), на пробных спектрах подобрать оптимальную величину поглощающего слоя; (l = 0,2 мм), снять их ИК-спектры в области 600 - 1000 см-1. Идентифицировать полосы поглощения характерные для каждого типа замещения. 2. Приготовить эталонные смеси ксилолов принесло со следующим содержанием изомеров:
Взять по 1 мл каждой из приготовленных смесей и разбавить 20 мл циклогексана. Снять ИК-спектры растворов в области 600 - 1000 см-1 ПРИ ВЫБРАННОЙ РАНЕЕ ТОЛЩИНЕ ПОГЛОЩАЮЩЕГО СЛОЯ. По спектру первого раствора выбрать аналитические полосы поглощения для каждого из ксилолов, затем, используя данные по всем растворам, построить градуировочные графики для каждого ксилола D = f(C).Концентрацию можно выразить в %. 3. Полученную у преподавателя смесь ксилолов разбавить циклогексаном в отношении 1:20, записать ИК-спектр и, пользуясь градуировочным графиком, найти концентрации изомеров в смеси. Форма отчета: ИК-спектры растворов, таблицы для каждого из приготовленных и исследуемых растворов. Привести градуировочные графики для каждого ксилола. Привести найденные концентрации изомеров в задаче. Спектральные данные для pacтвора 1.
Одним из приближенных методов определения электронодонорной способности лигандов является ИК-спектроскопический метод. Используя один из стандартных протонодоноров (фенол, метанол, хлороформ, фенилацетилен и др.) можно определить величину смещения водородной связи Δν(OH) = νсвоб(OH) - νсвяз(OH) Сопоставив подученное значение для исследуемого соединения с литературными данными можно указать место изучаемого лиганда в ряду других электронодонорных молекул. Используя различные эмпирические закономерности, можно рассчитать все термодинамические параметры образующейся водородной связи (ΔH°, ΔS°, ΔG°), иными словами все параметры равновесия XH + L = X–H···L Для более точного расчета термодинамических параметров равновесия следует использовать неэмпирические методы (см. работу 5). Задание к работе № 4. Приготовить примерно 20 мл исходного 0,01 М раствора фенола (п-хлорфенола, п-крезола и т.д.) в СС14. 3 мл этого растворе, разбавляются 3 мл CCl4 до концентрации 0,005 м/л. Регистрируется спектр этого раствора в области 2600-3700 см-1 при толщине поглощающего слоя 4 - 5 мм, находится ν(ОН) неассоциированных молекул фенола. Готовятся по 3 - 4 мл 0,04 м/л раствора изучаемых лигандов (5 - 6 веществ из следующих: CH3CN, XC6H4CHO, XC6H4COOH, (C2H5)2O, XC3H4COOCH3, ТГФ, диоксан, XC6H4NH2, HCON(CH3)2, (CH3)2SO, C6H5NO, CH3COC2H5, (C4H9O)PO, (C2H5)3N, C5H5N и др.) в CCl4. 3 мл каждого из приготовленных растворов смешивается с 3 мл исходного раствора фенола, так, что получаются растворы, содержание фенол и лиганд в соотношении 1:4 (концентрация 0,005 и 0,02 м/л). Производится запись спектров этих растворов в интервале молекул фенола. Рассчитывается Δν(ОН) ассоциированных в комплексе молекул фенола. Обратить внимание на взаимосвязь интенсивности ν(OH) неассоциированных молекул фенола с величиной Δν(OH). По эмпирическому соотношению типа Бэджера - Бауэра рассчитывается энергия образования водородной связи в комплексе ΔH° = - 67Δν(OH) - 2638 (Дж/моль) Далее по уравнению Гурьяновой, справедливому для так называемых молекулярных комплексов рассчитывается изменение энтропии комплексообразования ΔS° = 0,00297ΔH + 33,5 (Дж/моль·К) Наконец, вычисляется изменение свободной анергии комплексообразования ΔG° = ΔH° - TΔS° (Дж/моль) Константа равновесия вычисляется по известному уравнению: Kp = e-ΔG/RT (здесь R = 8,314 Дж/моль·К) Форма отчета: ИК спектры растворов. Спектральные данные собираются в таблицу:
По интенсивности ν(ОH) неассоциированных молекул фенола (п-хлорфенола, крезола, п-нитрофенола и др.) можно рассчитать равновесную концентрацию свободного фенола в условиях следующего химического равновесия (L - органическое основание): C6H5OH + L = C6H5OH···L Так как константа ассоциации:
то, обозначив С°ф и С°л начальные концентрации фенола и лиганда и равновесную концентрацию фенола Сф, получаем расчетную формулу:
Для точного нахождения концентрации фенола следует предварительно построить калибровочный график D = f(C) по нескольким растворам фенола различной концентрации. Задание к работе № 5. 1. Приготовить примерно 30 мл исходного раствора фенола в СС14 с концентрацией 0,01 моль/л. Разбавлением получить из этого раствора 5 рабочих с концентрацией 0,001; 0,002; 0,004;0,006 моль/л по 20 мл. Снять ИК-спектры этих растворов в области ν(ОН). Наблюдать закономерное изменение интенсивностей свободной и связанной ν(OH). Для ν(ОН) свободной гидроксильной группы (ν = 3610 см-1) построить графическую зависимость D = f(C), которая должна представлять собой прямую линию, проходящую через начало координат. 2. Смешением 2 мл 0,01 моль/л раствора фенола в ССl4 и 3 мл 0,01 моль/л или 0,02 моль/л органического основания получают рабочий раствор комплекса, в котором концентрации С°ф и С°л вдвое меньше, чем в исходном. Снимают ИК-спектр этого раствора в области 2600 - 3700 см-1. Из оптической плотности в области ν(OH) свободных молекул фенола при 3610 см-1 определить при помощи градуировочного графика равновесную концентрацию фенола Сф. Произвести расчет констант устойчивости по приведенной выше формуле. В качестве лиганда можно использовать (C6H5)3PO, (C6H5O)3PO, (C4H9O)3PO, HC(O)N(CH3)2, C6H5COCH3, ТГФ и другие. Определяют константы ассоциации 2-3 веществ по указанию преподавателя. Форма отчета: представить ИК-спектры растворов, калибровочный график. Спектральные данные собирают в таблицу.
На основании полученных данных делают вывод об относительной электронодонорной способности лиганда.
Изучая температурный ход констант ассоциации можно рассчитать энергию образования Н-комплексов. В предельном случае, если считать, что ΔH° комплексообразования не зависит от температуры, можно ограничиться измерением Касс при двух температурах. Тогда:
Задание к работе № 6. Измерения проводят так, как описано в работе № 5, но в температурной кювете при двух температурах, например, при 25 °С и 45 °С, для 1-2 соединений по указанию преподавателя. Форма отчета: Представить ИК-спектры растворов, калибровочный график, спектральные данные оформляют в таблицу:
Повышению или понижению частоты поглощения функциональных групп, особенно таких сравнительно высокохарактеристических как (CO), (H2)N и др. можно установить место присоединения акцептора электронов (фенола или замещенных фенолов) к таким карбонильным соединениям как CH3C6H4COCH3, CH3OC6H4CHO, H2NC6H4COCH3, (CH3)2NC6H4CHO, O2NC6H4COCH3 и других. Задание к работе № 7. 1. Готовят по 10 мл исходных растворов фенола и карбонильных соединений в ССl4 с концентрацией 0,8 моль/л и 0,2 моль/л соответственно. Разбавляют исходные растворы равным объемом ССl4 и снимают спектры фенола и карбонильных соединений в области карбонильного поглощения (1900-1500 см-1) при толщине слоя 0,1-0,3 мм. Идентифицируют полосы поглощения группы C=O в альдегидах и кетонах. 2. Смешивают равные объемы (по 25 мл) исходных растворов фенола и карбонильного соединения, получая рабочие растворы, имеющие концентрацию 0,4 м/л относительно фенола и 0,1 м/л относительно карбонильного соединения. Снимают спектры растворов в области 1900-1300 см-1 при толщине слоя 0,1-0,3 мм. Идентифицируют полосы карбоксильного поглощения и по характеру смещения (понижение или повышение частоты поглощения, величина сдвига Δν(С=О) ) судят о локализации водородной связи и сравнительной прочности комплекса. Форма отчета: ИК-спектры растворов, таблица спектральных параметров, выводы.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||