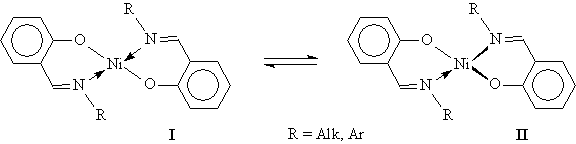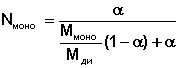|
Основной величиной, наиболее привычной для магнетохимиков, является так называемый магнитный момент иона. Чисто спиновое значение его, то есть вклад в магнитный момент, обусловленный только спином электронов, передается выражением
где μS – спиновый момент в единицах магнетона Бора, μB, S – суммарный спин неспаренных электронов, g – так называемый фактор расщепления Ланде, равный отношению магнитного спинового момента, выраженного в магнетонах Бора, к спину, для свободного электрона g = 2,0023.
Как показывает опыт, экспериментально определенные магнитные моменты комплексных соединений ионов металлов первого переходного периода в большинстве случаев оказываются близкими к вычисленным чисто спиновым значениям [1]. Причина этого заключается в так называемом замораживании орбитального момента кристаллическим полем лигандов, то есть уменьшении орбитального вклада в результирующий магнитный момент вследствие возмущающего действия лигандов на орбитальные состояния ионов переходных металлов в комплексах. В теории строения координационных соединений показано, что характер взаимного расположения энергетических уровней центрального атома в поле лигандов чувствителен к тонким деталям строения комплексов. В соответствии с этим магнитные свойства комплексов также существенно зависят от типа координации, замены одного лиганда на другой, изменения степени окисления ионов переходных металлов и т.д. Именно эта особенность выдвинула магнетохимический метод в ряд наиболее эффективных методов исследования электронного строения комплексных соединений переходных металлов. Общая схема получения необходимой информации из магнетохимических данных такова: в рамках определенной модели предполагаемого электронного и геометрического строения изучаемого соединения рассчитываются теоретические значения магнитного момента иона (которые могут и отличаться от чисто спиновых величин), затем проводится сравнение с экспериментом. При достаточно хорошем совпадении данных соответствующая модель строения принимается как наиболее вероятная. Конечно, в большинстве случаев желательно использовать сочетания магнетохимического метода с данными рентгеноструктурного анализа, спектроскопии ЭПР, инфракрасной и оптической спектроскопии и т.д. [2], однако относительная простота и экспрессность магнетохимического метода, как уже отмечалось выше, обусловливают подчас его уникальность. Так, например, с помощью этого метода для комплексных соединений двухвалентного никеля было доказано наличие в растворах структурного равновесия квадрат-тетраэдр, представленного схемой
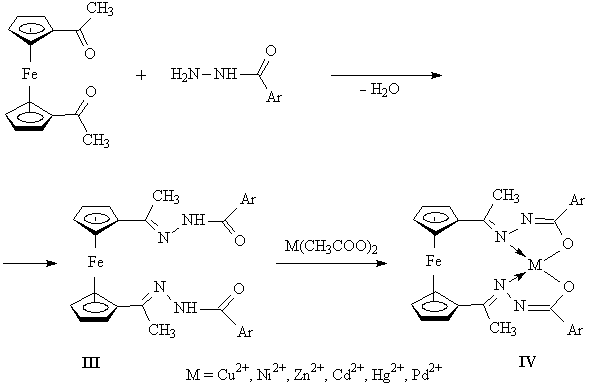
В рамках теории кристаллического поля [3] можно показать, что комплексы двухвалентного никеля, в которых координационный узел центрального иона имеет плоскостное строение (структура I), являются диамагнитными, все восемь электронов 3d-подуровня иона Ni спарены. В то же время комплексы с тетраэдрическим или октаэдрическим строением координационного узла (структура II) являются парамагнитными, поскольку в этих случаях ион Ni2+ имеет два неспаренных электрона. Учитывая, что результирующий магнитный момент многокомпонентной системы, как и величина магнитной восприимчивости, обладает свойством аддитивности, относительно легко может быть решена и аналитическая задача – определение концентрации каждого из компонентов (в нашем случае соединений I и II). Подобных примеров можно было бы привести чрезвычайно много. Желающим более детально познакомиться с современным состоянием исследований в области магнетохимии комплексов переходных металлов рекомендуем уже упоминавшуюся монографию [3], а также статьи в журналах "Координационная химия" и "Журнал неорганической химии" за последние годы. В рамках данной статьи представляется уместным показать, как использование классических приемов традиционных физических методов исследования при неформальном творческом подходе к анализу результатов позволяет устанавливать совершенно новые и неожиданные характеристики вещества. Так, анализ литературных данных показал, что магнитным свойствам гетерометаллических комплексов производных ферроцена [4] не уделялось должного внимания. Тем не менее известно, что сам ферроценовый фрагмент во всех соединениях, изученных магнетохимическим методом, является диамагнитным, подобно исходному незамещенному ферроцену. В соответствии с особенностями электронного строения ферроцена, равно как и многих других сэндвичевых соединений, считается, что атом железа в нем находится в нулевой степени окисления, причем все шесть электронов d-подуровня являются спаренными. В этой связи представлялось интересным определить, возможно ли путем перевода производных ферроцена в состояние биядерных комплексов (то есть содержащих атомы железа и какого-либо металла) изменить магнетохимические характеристики ферроценового фрагмента. С этой целью были направленно получены "лиганды" III и комплексы на их основе IV [5]:
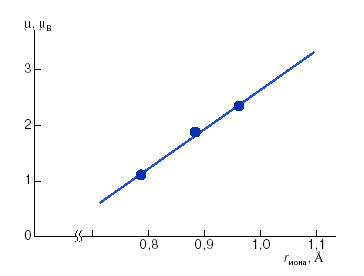
Измерение магнитных моментов комплексов IV показало, что в отличие от исходных диамагнитных лигандов III все они парамагнитные, причем величины магнитных моментов для М = Cu2+, Ni2+ значительно превышают чисто спиновую величину, а для комплексов с ионами металлов, не содержащими неспаренных электронов на d-подуровне ("диамагнитными"), то есть с Zn2+, Cd2+ и Hg2+ они находятся в интервале 1,14 – 2,54 μB (табл. 1). Можно было бы предположить, что аномальные магнитные свойства комплексов типа IV обусловливаются появлением парамагнетизма ферроценового фрагмента из-за отклонения циклопентадиенильных колец от копланарности вследствие структурных искажений, возникающих в ферроценовом фрагменте при комплексообразовании. В пользу такого предположения свидетельствовала линейная корреляция между значениями магнитных моментов комплексов IV с М = Zn2+, Cd2+, Hg2+ и величинами ионных радиусов этих металлов (рис. 1).
Рисунок 1
Таблица 1
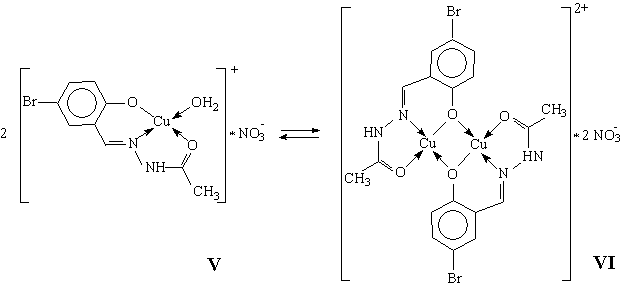
Следующий пример демонстрирует прикладные возможности магнетохимического метода исследования. Хорошо известно, что для защиты металлов от коррозии широко используют так называемые компаунды – смеси веществ преимущественно неорганической природы, образующие защитные пленки на поверхности материалов после соответствующей обработки. Примером является компаунд марки ПМС-Ю, представляющий собой суспензию алюминиевого порошка в растворе H3PO4 с добавками СrO3 и МgO. Защитная пленка образуется при нанесении данного компаунда на поверхность металла с последующей термической обработкой при t ~ 500 °C [6]. Изучение физико-химических характеристик этого покрытия показало, что оно, во-первых, обладает двухфазной структурой, состоящей из слоя металлического алюминия и стекловидной массы серо-зеленого цвета, и, во-вторых, твердость слоя, а также его коррозионная стойкость и адгезионные свойства существенно выше, нежели у алюминиевых покрытий. При этом в первую очередь обращало на себя внимание то необычное обстоятельство, что компактный алюминиевый слой образовался при температуре, существенно более низкой, нежели температура плавления чистого алюминия (660,1 °C). Привлечение магнетохимического метода позволило определить механизм формирования и защитного действия данного покрытия. Так, было установлено, что все покрытия после термообработки становятся парамагнитными в отличие от исходного практически диамагнитного компаунда (слабым парамагнетизмом порошка металлического алюминия в данном случае можно пренебречь). Появление парамагнетизма могло быть объяснено единственным образом: как результат окислительно-восстановительной реакции между бихромат-ионами и металлическим алюминием, упрощенно представленной схемой 2Al + Cr2O72– + 8H+ ––> Cr2O3 + 2Al3+ + 4 H2O Образующиеся атомы хрома в степени окисления +3 в отличие от исходных атомов в степени окисления +6 обладают тремя неспаренными электронами. По известным из литературных данных значениям эффективного магнитного момента для атомов Сr3+ в оксиде Сr2O3 удалось рассчитать его количественное содержание в защитном покрытии, практически совпавшее с позже полученными результатами классического аналитического исследования. Именно появление оксида хрома(III) способствовало образованию вместе с полифосфатами магния и алюминия стекловидной фазы покрытия. При этом оксид хрома(III) являлся основным компонентом, обусловливающим повышение твердости и стойкости покрытия. Кроме того, понижение температуры плавления алюминия было вызвано образованием низкоплавкой эвтектики, состоящей из смеси Al, Cr2O3 и полифосфатов магния. На основании результатов исследования были предложены практически важные пути направленного модифицирования состава и свойств защитных компаундных покрытий. Ограничение магнетохимического метода рамками рассмотренных выше примеров и положений не позволяет составить полноценное представление о возможностях метода. В частности, наиболее ярко эти возможности раскрываются при изучении магнетохимического поведения полиядерных комплексных соединений (обменных кластеров), в которых упорядочение спинов неспаренных электронов [1] реализуется в пределах изолированной молекулы. И хотя даже качественное их рассмотрение заслуживает отдельного обсуждения, приведенный ниже частный результат исследования обменных кластеров находится, на наш взгляд, в общем русле примеров, когда нестандартный подход экспериментатора к возможностям того или иного физического метода позволяет несколько сместить ограничительные рамки этих возможностей. Так, было показано, что комплекс V при комнатной температуре и атмосферном давлении самопроизвольно димеризуется в твердой фазе в соединение VI, причем процесс димеризации в указанных условиях необратим [7]:
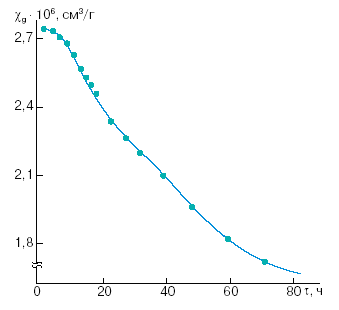
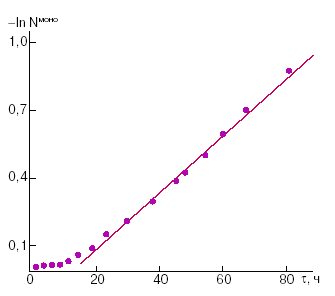
Комплексное соединение VI является одним из простейших примеров упомянутых полиядерных координационных соединений, то есть систем, в которых изолированная молекула комплекса содержит два или большее число ионов металла. При этом если данные ионы парамагнитны, то между ними реализуется так называемое обменное взаимодействие, электростатическое по своей природе, приводящее в зависимости от особенностей электронного и геометрического строения полиядерной молекулы к ферро- или антиферромагнитному упорядочению спинов [1]. Поэтому, например, при антиферромагнитном характере взаимодействия спаривание спинов двух ионов Сu2+ (S = 1/2) в комплексе VI приводит (даже при комнатной температуре) к существенно заниженному значению магнитного момента в расчете на один ион Сu2+ по сравнению с чисто спиновой величиной 1,73 μB . Последнее обстоятельство и послужило основой применения метода измерения статической магнитной восприимчивости для изучения кинетических особенностей процесса димеризации V – VI. Хорошо известно, что удельная χM и молярная магнитные восприимчивости вещества являются величинами аддитивными, поэтому экспериментальное значение χg образцов, в которых протекает приведенное выше превращение, очевидно, может быть выражено через удельные магнитные восприимчивости мономера и димера следующим образом:
где α – массовая доля мономера в образце. Значение мольной доли мономера в образце N моно рассчитывали по формуле
где Ммоно и Мди – молекулярная масса мономера и димера соответственно.
Рисунок 2 Рисунок 3
(К = – 0,0153 ± 0,0002 ч-1, b = 0,1595 ± 0,0008, коэффициент корреляции R = 0,9988), которое аналогично кинетическому уравнению для реакции первого порядка. Вместе с тем приведенные данные показывают, что в процессе димеризации наблюдается известный период индукции (τ <10 ч), отвечающий, по-видимому, структурным изменениям в кристаллической решетке образцов.
1. Глебов А.Н., Буданов А.Р. Магнетохимия: Магнитные свойства и строение веществ // Соросовский Образовательный Журнал. 1997. № 7. С. 44-51. 2. Вилков Л.В. Физические методы исследования в химии // Там же. 1996. № 5. С. 35-40. 3. Калинников В.Т., Ракитин Ю.В. Введение в магнетохимию. М.: Наука, 1980. 302 с. 4. Леменовский Д.А. Сандвичевые металлокомплексные соединения. Ферроцен // Соросовский Образовательный Журнал. 1997. № 2. С. 65-69. 5. Коган В.А., Морозов А.Н., Луков В.В. // Журн. неорган. химии. 1988. Т. 33, № 1. С. 133-139. 6. Мислер Ж.В., Луков В.В. и др. // Защита металлов. 1989. Т. 25, № 4. С. 675-678. 7. Левченков С.И., Луков В.В., Коган В.А. // Координац. химия. 1997. Т. 23, № 5. С. 380-382.
|
|||||||||||||