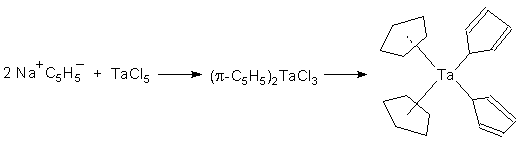|
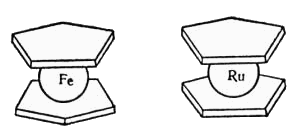
Открытие в 1951 году ди-π-циклопентадиенилжелеза (π-С5Н5)2Fe независимо и практически одновременно тремя группами исследователей, возглавляемых Посоном, Вудвордом и Миллером, стимулировало целый ряд многочисленных работ, связанных с синтезом аналогичных циклопентадиенильных комплексов многих переходных и непереходных металлов, выделенных впоследствии в особый класс металлоорганических соединений и названных металлоцены. Для первого представителя этого класса, ди-π-циклопентадиенилжелеза, Вудвордом был предложен термин, «ферроцен», который стал общепринятым. Необычность ряда свойств ферроцена потребовала более детального изучения его структуры, которая и сейчас удивляет исследователей: в ферроцене атом железа как бы зажат между двумя плоскими циклопентадиенильными кольцами, обнаруживая образную аналогию с бутербродом (сэндвич), см. рис.:
Различными физическими и химическими методами, в частности рентгеноструктурно, было показано, что в отличие от соединений с σ-связью металл-углерод (в алкильных производных), в металлоценах циклопентадиенильная группа присоединена к металлу за счет π-связи. В кристаллическом состоянии молекула ферроцена имеет заторможенную конформацию, в которой атомы углерода в соседних пятичленных кольцах расположена в шахматном порядке один относительно другого, а рутеноцен имеет заслоненную конформацию - атомы углерода один под другим. Т. к. барьер свободного вращения колец вокруг своей оси весьма мал, то их относительная ориентация определяется, в основном, условиями упаковки в кристаллической решетке и зависит от температуры. Нейтральные металлоцены и их производные получены для всех элементов первого ряда переходных элементов. За исключением комплексов марганца, все они имеют то же строение, что и ферроцен. Однако лишь ферроцен устойчив на воздухе, другие соединения неустойчивы: их устойчивость убывает в ряду Ni > Co > V > Cr > Ti. Многолетнее изучение металлоценов показало, что они имеют широкую практическую применимость. При этом как практический, так и непосредственно теоретический интерес представляют молекулярные комплексы на основе ферроцена, его производные, позволяющие получать внутрикомплексные соединения, целый ряд гетерометаллических производных. Они находят применение, наряду с металлоценсодержащими полимерами, в качестве полупроводниковых материалов в электронике, катализаторов в органическом синтезе и т.д. Системы, содержащие несколько гетерометаллов в пределах одной молекулы, представляют интерес и как модели для развития общей теории обменных взаимодействий. Имеются сведения о том, что хелатные комплексы переходных металлов, содержащие ферроценовый фрагмент, оказались катализаторами полимеризации стирола, наряду с хелатами на основе другого π-комплекса - циклопентадиенилтрикарбонилмарганца (ЦТМ, цимантрен). Можно ожидать от таких соединений и повышенной биологической активности, в связи с чем возможно их применение в фармакопее. В особенности перспективны в этом отношении комплексы, содержащие помимо ферроценового фрагмента другие группировки - например, гидразоновые - биологическая активность которых хорошо известна.
Взаимодействие циклопентадиенидов щелочных металлов с солями или комплексом металлов. Этот наиболее общий и удобный способ получения металлоценов и их производных реализуется по схеме: 2NaC5H5 + MCl2 –––> (π-C5H5)2M + 2NaCl (кипячение в ТГФ) В зависимости от соотношения реагентов можно получать различные продукты реакции: в ряде случаев применение большого избытка циклопентадиенида натрия приводит к образованию комплексов, содержащих как π-, так и σ-циклопентадиенильные лиганды (схема 1):
Схема
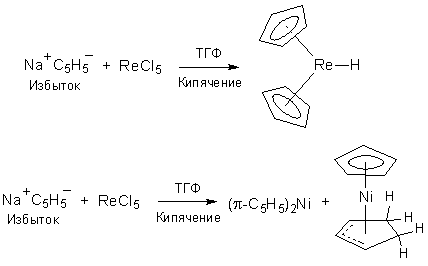
1. Иногда подобные реакции приводят к совершенно неожиданным продуктам (схема 2):
Схема
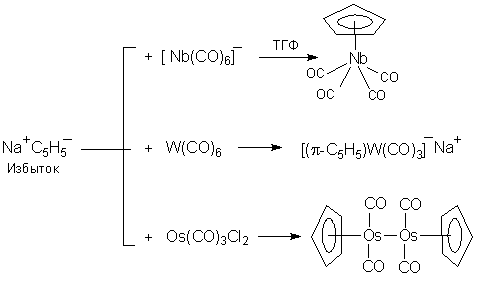
2. При взаимодействии карбонилов металлов получаются соответствующие π-циклопентадиенилметаллкарбонилы (схема 3):
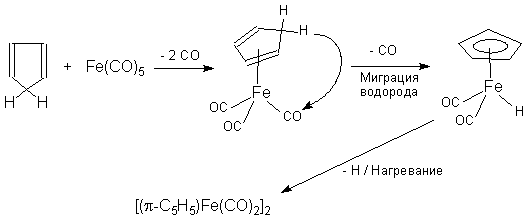
Схема 3. Взаимодействие циклопентадиена с солями или комплексами металлов. Эта реакция идет с отщеплением кислого атома водорода метиленовой группы циклопентадиена по схеме: MCl2
+ 2C5H6 Этим методом получают металлоценовые комплексы железа, кобальта и титана. Кроме того, этим методом также получаются карбонильные производные металлоценов, например, для карбонилов железа по схеме 4:
Схема
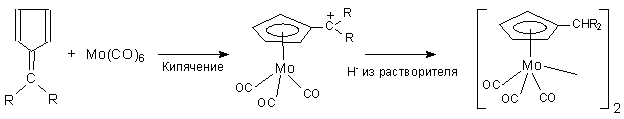
4. Наряду с этим карбонильные производные металлоценов получаются реакцией карбонилов металлов с фульвенами по схеме 5:
Схема
5. Читать дальше: Части III - IV
|