|
Некоторые основные характеристики для ряда типичных металлоценов приведены в таблице 1: Таблица 1. Некоторые бис-π-циклопентадиенильные комплексы металлов.
Как отмечалось, металлоцены термически устойчивы, многие из них плавятся без разложения. Металлоцены устойчивы к гидролизу и каталитическому гидрированию; ферроцен даже более устойчив к гидрированию, чем бензол. Считается, что π-связанное циклопентадиенильное кольцо во многих отношениях, в частности, порядком связи C-C (табл. 2), напоминает бензол, и можно ожидать, что оно будет обладать ароматическим характером. В этом плане наиболее широко изучены химические свойства ферроцена. Оказалось, что он ацилируется по Фриделю-Крафтсу, металлируется бутиллитием, сульфируется и т.д., то есть он вступает в реакции, характерные для типичных ароматических соединений. Аналогично ведут себя и другие металлоцены, не разлагающиеся в указанных реакциях. Как отмечалось, устойчивость металлоценов к окислению изменяется в широких пределах. При комнатной температуре ферроцен устойчив к действию кислорода, в то время, как хромоцен на воздухе самовозгорается. Все металлоцены в кислых растворах способны, как правило, обратимо окисляться до соответствующих катионов. Ферроцен в кислых растворах дает дихромные сине-зеленые, а при больших концентрациях - кроваво-красные растворы катиона феррицения [(π-C5H5)2Fe]+. Прямым подтверждением своеобразия строения металлоценов является рентгеноструктурный анализ, некоторые результаты которого приведены в таблице 2. Таблица 2. Длины связей в π-циклопентадиенильных комплексах переходных металлов.
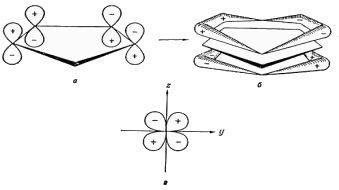
Диамагнетизм ферроцена, имеющего формально двухвалентный ион железа, который должен проявлять парамагнетизм, его ароматический характер, проявляемый в химических реакциях, объясняется с позиций своеобразия электронного перераспределения при образовании молекулы ферроцена и подобных ему металлоценов. Принято считать, что в π-циклопентадиенильных лигандах σ-связи атомов углерода друг с другом и с атомом водорода не принимают участия в образовании связей лиганда с металлом. Анион C5H5- построен в виде плоского симметричного пятиугольника. У каждого атома углерода имеется орбиталь pz, перпендикулярная плоскости кольца. Из этих атомных pz- или 2pπ-орбиталей образуются молекулярные (МО) π-орбитали. Существует 5 таких МО, из которых три нижние по значению энергии заняты тремя парами электронов. Связь с металлом образуется за счет перекрывания заполненных МО колец с незаполненными атомными орбиталями железа; одновременно с этим заполненные орбитали железа перекрываются с незанятыми МО аниона C5H5- , осуществляя дативное (обратное) взаимодействие. На рис. 2а показаны атомные pz-орбитали четырех атомов углерода циклопентадиенильного кольца, а рис. 2б соответствует общему виду МО группы C5H5, образующихся за счет перекрывания атомных орбиталей. Эта одна из трех МО, заполненных электронами:
Рис. 2.
Схема образования связи в π-циклопентадиенильных
соединениях ферроцена с точки зрения
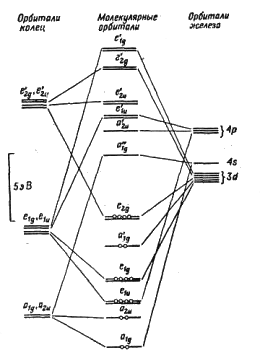
теории МО. На рис. 2в показана незанятая атомная dyz-орбиталь иона железа, для которой плоскость xz является узловой. МО кольца и dyz-орбиталь железа соответствуют одна другой по симметрии и могут перекрываться с образованием химической связи. Наряду с этим вакантная dzx-орбиталь железа способна перекрываться с заполненной π-МО второго кольца железа C5H5 (такой же, как МОЛ на рис. 2б), в результате чего и образуется сэндвичевая структура. Полная молекулярная диаграмма ферроцена была дана в работе Дяткиной и Шустровича и приведена на рис. 3:
Рис. 3 Описание связей в ферроцене с помощью теории МО оказалось очень успешным, так как правильно объясняет наблюдаемые физико-химические свойства, в частности, объясняется диамагнетизм молекулы ферроцена, т.к., согласно молекулярной диаграмме (рис. 3), неспаренных электронов не должно быть. Наблюдается хорошее совпадение рассчитанного значения ионизационного потенциала 6,39 эВ с экспериментальным 6-8 эВ. Рассчитанное значение положительного заряда на атоме железа (+0.7) сопоставимо с величиной (+0.4), полученной на основании изучения К-края поглощения рентгеновских лучей. Такое электронное строение также соответствует химическому поведению металлоценов, т.е. согласуется с той легкостью, с которой многие металлоцены вступают в реакцию электрофильного замещения атома водорода циклопентадиенильных колец. Кроме того, магнитные измерения металлоценов также подтверждают теоретические предсказания об электронном распределении в них (см табл. 3). Таблица 3. Данные магнитных измерений и заполнение электронами высших орбиталей в бис-π-циклопентадиенильных комплексах.
* Cp2 = (π-C5H5)2 Измеряемая величина магнитной восприимчивости соответствует числу неспаренных электронов в комплексе, а различия между «чисто спиновыми» и экспериментальным значениями магнитного момента указывают на вклад орбитальной составляющей; например если неспаренный электрон находится на орбиталях, магнитное квантовое число которых равно нулю (m = 0, т.е. на орбиталях 4S, 4pz и 3dz2), то орбитальная составляющая магнитного момента равна нулю. Однако если неспаренный электрон находится на орбитали dx2-y2 или dxy (m = ±2), то он имеет орбитальную составляющую, отличную от нуля, и, следовательно, наблюдаемый магнитный момент больше «чисто спинового» значения. Наконец, если имеется по одному неспаренному электрону на орбиталях dx2-y2 и dxy, то вклад орбитальной составляющей в величину магнитного момента снова равен нулю. Подобный подход лежит в основе описания электронного строения бис-π-циклопентадиенилов переходных металлов 3d-ряда, приведенного в табл. 3. Химия металлоценов и их производных и в настоящее время бурно развивается. Более подробные сведения о металлоценах, π-комплексах и других металлорганических соединениях даны в списке литературы.
1. Фишер Э., Вернер Г. «π-комплексы металлов», М.: Мир, 1968. 2. Посон П. «Химия металлорганических соединений », М.: Мир, 1970. 3. Моисеев И.И. «π-комплексы в жидкофазном окислении олефинов», М.: Наука, 1970. 4. Губин С.П., Шульгин Г.Б. «Химия комплексов со связями металл-углерод», Новосибирск, Наука, 1984
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||