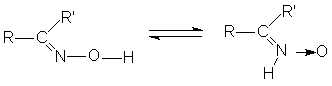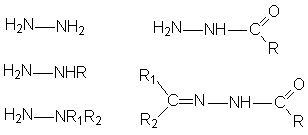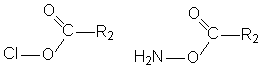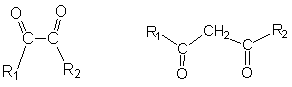|
ТЕОРИЯ СТРОЕНИЯ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ Курс лекций для студентов химфака ЮФУ (РГУ) ТИПЫ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ Характерные особенности координационных соединений – Примеры комплексных соединений Характерные особенности координационных соединений 1. Важнейшей особенностью координационных соединений является то, что число ближайших «соседей» центрального атома превышает его собственную валентность (степень окисления). Вследствие этого образуются дополнительные координационные связи, зачастую имеющие донорно-акцепторный характер. В общем случае (например, для комплексов Вернера) комплексное соединение представляет собой ядро – центральный атом металла комплексообразователя – и координированные лиганды, которые в случае вернеровских комплексов могут представлять собой заряженные ионы (кислотные остатки неорганических и простейших органических кислот) или нейтральные молекулы (вода, аммиак, амины и др.). Число ближайших соседей определяется координационным числом металла-комплексообразователя. В зависимости от координационного числа и пространственного расположения лигандов (точнее, их донорных атомов – для аммиака это атомы азота) различают различные пространственные структуры: ▪ квадрат (координационное число 4) ▪ тетраэдр (координационное число 4) ▪ бипирамида (координационное число 5, 6, 7 и т.д.) ▪ тетрагональная пирамида (координационное число 5) ▪ октаэдр (координационное число 6) Существуют и другие способы геометрической организации структуры комплексного иона. Совокупность иона металла-комплексообразователя и лигандов образую так называемую внутреннюю координационную сферу. Именно ее состав и строение определяют физико-химические свойства и реакционную способность комплекса. Поэтому именно последней уделяется особое внимание при изучении и обсуждении свойств комплексов. 2. Вторая особенность заключается в изменчивости свойств комплекса и самой координационной связи в зависимости от того, какие лиганды и типы связывания реализованы во внутренней координационной сфере. Данное свойство получило название лабильности комплексов (и координационной связи). В органической химии для конкретных связей (например, С=О, С–Н, С=N, С–С, С–О, С=С и др.) существует определенный набор характеристик: длина связи, ее дипольный момент, поляризуемость, валентный угол, образуемый данной связью по отношению к прочим связям в молекуле, рефракция. Для координационной связи между двух атомов такого набора не существует, поскольку каждая величина зависит не только от того, какие именно атомы ее образуют, но и от того какие атомы и связи соседствуют с указанной парой атомов (частиц). 3. Поскольку комплексные соединения образуют чаще всего d- и f-элементы, то у комплексов есть ряд особенностей, обусловленных участием этих орбиталей в образовании координационной связи. Приведем некоторые из этих особенностей: А) Магнитные свойства комплексов. Парамагнетизм – это свойство химических соединений взаимодействовать особым образом с внешним магнитным полем. Если в молекуле есть парамагнитный центр, то есть атом (или другая частица), содержащая неспаренные электроны, то такое соединение будет втягиваться в магнитное поле. Сила такого взаимодействия определяется так называемой удельной χg (или молярной χm) магнитной восприимчивостью или эффективным магнитным моментом μeff соединения. Которые в свою очередь зависят прежде всего от количества неспаренных электронов. Такие соединения называют парамагнитными. Если парамагнитных центров нет, то соединение практически не взаимодействует с внешним магнитным полем (точнее, незначительно из него выталкивается). Многие металлы при одной и той же степени окисления и постоянном координационном числе могут проявлять различные магнитные свойства, в зависимости от того, какие лиганды вошли во внутреннюю координационную сферу. Например: [Co(NH3)6]3+ – диамагнитен (S=0) [CoF6]3– – парамагнитен (S=2) Магнитные свойства комплексов являются основой для применения при их изучении таких физико-химических методов, как ЭПР, ЯМР, метод магнетохимической восприимчивости, способствующих установлению структуры координационного соединения. Б) Интенсивная окраска координационных соединений. В) Многообразие способов гибридизации и валентных состояний, вызванные активностью d- и f- орбиталей. Из этого следует вывод о многообразии таких свойств центрального иона (и всего комплекса в целом), как окислительно-восстановительные потенциалы, реакционная способность, стереохимические особенности) и т.д. 4. Еще одной особенностью координационных соединений является разнообразие лигандов, образующих комплексы. Рассмотрим основные типы лигандов, дающие координационные соединения. Амины (первичные, вторичные, третичные)
Нитрилы.
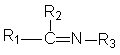
Имины и оксимы
Производные гидразина
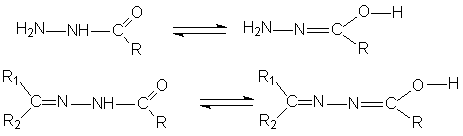
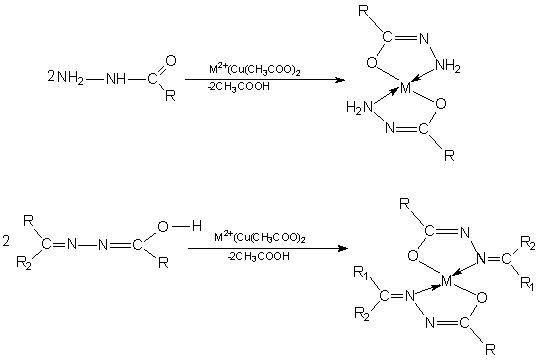
Следует отметить, что радикалы R, R1, R2 не являются пассивными заместителями, а играют исключительную, подчас определяющую, роль при организации структуры комплекса и сообщении ему тех или иных свойств. Так простейшие производные гидразина (показанные слева), содержащие в качестве заместителей тривиальные ароматические или алифатические радикалы, дают с переходными металлами довольно простые координационные соединения, называемые молекулярными комплексами или аддуктами (от англ. to add – добавлять). Введение же в их молекулы карбонильной группы (С=О) дает так называемые гидразиды органических кислот (ацил- и ароилгидразины) и гидразоны (ацил- и ароилгидразоны карбонильных соединений), получаемые по реакции конденсации соответствующего карбонильного соединения – альдегида или кетона – с соответствующим гидразидом кислоты. При координации данных соединений атомом металла лиганд может координироваться в двух таутомерных формах, одна из которых кето-иминная, а вторая ен-иминная: Такая трансформация лиганда способствует образованию комплексов особого типа, которые называются внутрикомплексными соединения или металлохелатами:
Такие соединения содержат атом металла, включенный в молекулу комплекса посредством двух типов связей – обычной химической связи и связи, образованной с помощью донорно-акцепторного механизма. Радикалы, находящиеся в гидразоновой части молекулы могут влиять на пространственную изомерию (на рисунке показаны только транс-изомеры; цис-изомеры также возможны к образованию, что определяется также природой самого металла-комплексообразователя и другими факторами. Азометины
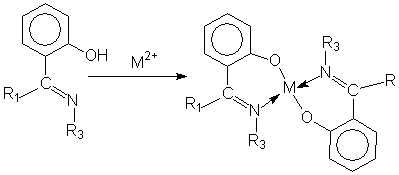
Здесь, как и в предыдущем случае, заместитель играют определяющую роль при образовании структуры соединения и типа получаемого комплекса. Так известно большое количество комплексов хелатного типа с салицилальдиминами. Они получаются взаимодействием азометина, содержащего в качестве заместителя R1 (или R2) орто-оксифенил.
В этом случае также в зависимости от условий синтеза и типа металла комплексообразователя могут быть получены цис- и транс-изомеры, а также комплексы, в которых ион металла имеет тетраэдрическое окружение. Азо-соединения.
Все указанные Лиганды относятся к так называемым N-донорам, так как в них координационная связь образуется за счет подачи неподеленной электронной пары атома азота на свободные d-орбитали атома металла. Если же в качестве донорного атома выступает атом кислорода, то можно выделить следующие основные типы О-доноров. Простые эфиры и сложные эфиры.
Амиды и хлорангидриды кислот
Карбонильные соединения (альдегиды и кетоны).
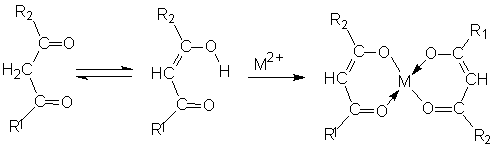
Следует отметить, что лиганда может содержать не один, а несколько донорных атомов. Такие лиганды называют полидентантными. Если рассматривать с этой позиции кетоны, то при введении в молекулу лиганда дополнительной кетоновой группировки получают бидентантные лиганды – α-дикетоны и β-дикетоны:
Для β-дикетонов получено большое количество разнообразных комплексов, имеющих хелатное строение, что связано с возможностью перехода кетоновой группировки в енольную форму, дающую при комплексообразовании хелатные комплексы:
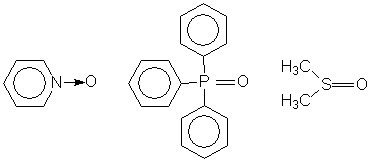
Оксиды гетероэлементов.
Нитрозосоединения
Существуют и другие типы доноров (S-доноры, Р-доноры), и прочие их виды, например, дифенилтеллуроксид, трифенилвисмут, в которых в качестве донорного атомы выступает гетероэлемент – теллур, висмут. Поскольку мы коснулись классификации лигандов по типу донорного атома, то следует привести еще одну, более общую классификацию (таблица 4). Комбинируя в рамках одной молекулы различные типы лигандов можно получить огромное число координационных соединений, причем свойства их будут принципиально отличаться, так как такие комплексы могут относиться к совершенно разным типам. (Достаточно взглянуть на любой комплекс Вернера и любой карбонильный комплекс металлов, чтобы понять, что между этими соединениями мало общего). Таблица 4. Классификация лигандов.
|
||||||||||||||||||||||||||