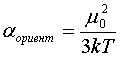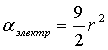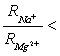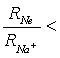|
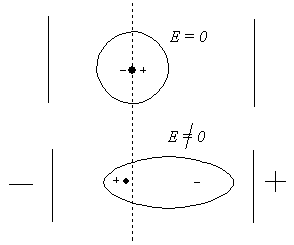
ТЕОРИЯ СТРОЕНИЯ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ Курс лекций для студентов химфака ЮФУ (РГУ) ПОЛЯРИЗАЦИОННЫЕ ПРЕДСТАВЛЕНИЯ В ХИМИИ КС Поляризация ионов – Поляризуемость и рефракция комплексных ионов – Поляризующее действие ионов – Количественная трактовка поляризационных представлений – Применение поляризационных представлений Поляризация ионов В рассмотренной выше простой электростатической модели имеются недостатки, самыми явными из которых являются следующие: ▪ Не всегда хорошо описывала даже ионные комплексы. ▪ Плохо согласовывалась с экспериментальными данными для комплексов тяжелых металлов, поскольку в них связь имеет значительную ковалентную составляющую. ▪ Простая электростатическая теория предполагает, что ионы взаимодействуют как упругие шары. На самом деле их электронные оболочки существенно деформируются при взаимодействии. ▪ Простая электростатическая теория не учитывает влияния растворителя. Многочисленные экспериментальные данные свидетельствуют о том, что при химическом взаимодействии ионов (и других частиц) они подвергаются деформации, т.е. их электронные оболочки меняют форму под действием электрического поля, создаваемого другими частицами их окружения. Поляризуются и молекулы растворителя при сольватации. Процессы поляризации при координировании различных частиц металлом-комплексообразователем необходимо учитывать. Поляризационные представления в химии КС были развиты и применены в работах Фаянса, Ван-Аркеля, Де-Бура и др. Под действием электрического поля, создаваемого любым ионом, полярной молекулой, происходит процесс поляризации, т.е. смещение «центров тяжести» зарядов на некоторое расстояние l и появляется индуцированный дипольный момент, обозначаемый как μ. Величина дипольного момента пропорциональна напряженности поля Е: Рисунок 7. Электронная поляризация в постоянном электрическом поле, напряженностью Е.
где α – коэффициент пропорциональности, называемый поляризуемостью; он является мерой электрической эластичности иона. Существует три вида поляризации и соответствующей им поляризуемости – электронная, ядерная, ориентационная. Последняя зависит от температуры и от постоянного дипольного момента молекулы, возникновение которого связано с разностью электроотрицательностей связанных атомов и смещением электронной плотности (заряда) от менее к более электроотрицательному атому.
μо – постоянный дипольный момент молекулы. При действии на вещество переменного электрического поля высокой частоты ориентационная и ядерная поляризация отсутствуют. При этом в качестве поляризующего поля можно взять свет, имеющий магнитную и электрическую составляющую. Электронную поляризацию, возникающую при действии света на вещество принято называть рефракцией R. R =4/3πNα Мы будем оперировать только электронной поляризацией или рефракцией. Поскольку электронная поляризуемость α является мерой деформации электронных орбиталей то она должны быть того же порядка что и размеры орбиталей и иметь порядок r3 (r – Боровский радиус). Теория показывает, что для сферически симметричного иона:
Поляризуемость αэлектр, т.е. склонность к деформации под действием электрического поля возрастает ▪ с увеличением главного квантового числа n электронной оболочки ( т.е. при ее удалении от ядра); ▪ с увеличением орбитального квантового числа ℓ; ▪ при частичном заполнении электронных оболочек (т.е. поляризуемость переходных металлов больше, чем у непереходных). Поскольку инерция у электронов очень мала, то деформация их орбиталей под действием переменного поля будет успевать за изменением напряженности поля Е. Это дает возможность применить электромагнитную теорию света Максвелла для нахождения αэлектр.
Т.е. измерив опытным путем n (показатель преломления) можно найти рефракцию и поляризуемость соединения, пользуясь свойством аддитивности рефракции, т.е. Rмолекулы=∑Rатомов+∑Rсвязей Так можно найти R для отдельного атома в ковалентных соединениях. Но нахождение рефракции ионов из рефракции ионного соединения невозможно. Поясним это: RH = 1/2 RH2 Измерив найдем RH2 и RH. Для ионов это невозможно, так как не существует ионов H22+, K22+ и т.д. Поэтому для оценки величины R ионов необходимо сделать теоретическое предположение о значении R хотя бы одного иона или об отношении численных величин рефракций двух различных ионов. Из многих попыток в этом направлении наиболее удачны работы Фаянса, который сопоставлял экспериментальные рефракции растворов солей и рефракций инертных газов. При этом были сделаны следующие качественные предположения: 1. Если положительный ион имеет такую же электронную конфигурацию, как и ближайший инертный газ, то это приводит к упрочнению связи электронов с ядром, т.е. к уменьшению поляризуемости такого иона по сравнению с поляризуемостью инертного газа. (Обоснование этого предположения – электростатическое т.к. у иона металла положительный заряд ядра больше чем у инертного газа). 2. Снижение поляризуемости иона при увеличении положительного заряда тем меньше, чем больше уже имеющийся положительный заряд и чем больше число электронных оболочек (главное квантовое число n) Согласно положению 1: RNa+< RNe Согласно положению 2: Очевидно, что присоединение электрона к атому и образование аниона приведет к увеличению его поляризуемости по сравнению с поляризуемостью инертного газа. Предположив, что поляризуемость H+=0 (у него нет электронов) можно рассчитать поляризуемости отдельных ионов. Таблица 10. Поляризуемость ионов.
Все указанные данные и расчеты касаются только сферических ионов с оболочками инертного газа. Для более сложных ионов и ионов переходных металлов эти расчеты неприменимы. Однако известно, что их поляризуемость намного больше поляризуемости непереходных металлов. |