|
ТЕОРИЯ СТРОЕНИЯ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ Курс лекций для студентов химфака ЮФУ (РГУ) ПОЛЯРИЗАЦИОННЫЕ ПРЕДСТАВЛЕНИЯ В ХИМИИ КС Поляризация ионов – Поляризуемость и рефракция комплексных ионов – Поляризующее действие ионов – Количественная трактовка поляризационных представлений – Применение поляризационных представлений Применение поляризационных представлений
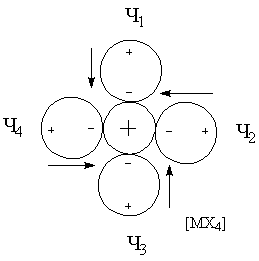
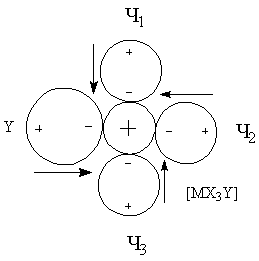
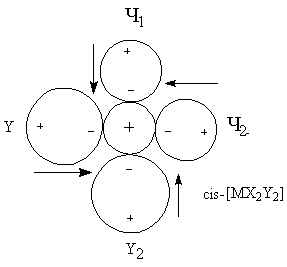
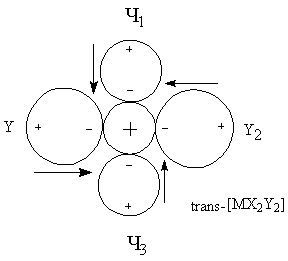
для трактовки При рассмотрении энергии комплекса и координационной связи металл-лиганд необходимо учитывать следующие характеристики и факторы: · Электростатические характеристики: заряд и радиусы центрального иона и лигандов · Величины постоянных дипольных моментов координированных лигандов · Поляризационные характеристики электронных орбиталей центрального иона и лигандов, то есть поляризуемость и поляризующее действие (α и β). Поляризационные представления объясняют многие экспериментальные данные. Рассмотрим несколько примеров. Пример 1. Известно, что щелочноземельные металлы дают более прочные гидратные комплексы, чем аммиакатные, а переходные металлы наоборот. Это находит отражение в том факте, что в водных растворах аммиакаты меди(II) образуются, а аммиакаты стронция(II) – нет. С чем это связано? ΔНобр[Sr(H2O)4]+4 = 146 ккал/моль > ΔНобр[Sr(NH3)4]+4 = 90 ккал/моль ΔНобр[Cu(H2O)4]+4 = 348 ккал/моль < ΔНобр[Cu(NH3)4]+4 = 388 ккал/моль μводы = 1.84 > μаммиака = 1.46 αводы = 1.49 < αаммиака = 2.21 Ион Sr+2 плохо поляризуется и устойчивость его в водных растворах обусловлена взаимодействием типа «ион-постоянный диполь». Так как дипольный момент воды больше, чем у аммиака, то акво-комплексы будут для него более устойчивыми. Ионы Cu+2 из-за наличия d-орбиталей поляризуются в значительной степени, а также оказывают сильное поляризующее действие на другие частицы. Поэтому здесь уже важна не только величина дипольного момента лиганда, но и его поляризуемость (и поляризующее действие). Именно поляризационные представления объясняют рост устойчивости комплексов в рядах: I- > Br- > Cl- > F- Te-2 >Se-2 > S-2 >O-2 Однако такая зависимость наблюдается не всегда. При малых значениях катиона определяющим фактором может стать критерии Ламберта (отношение радиусов), то есть геометрический фактор. Поляризационные представления объясняют существование полигалогенидов: MI + I2 = [MI3]-. Еще один пример применения поляризационных представлений – объяснение факта большей устойчивости иона аммония NH4+ по сравнению с гидроксонием H3O+. Протон обладает громадным поляризующим действием (огромный эффективный заряд за счет малого радиуса), поэтому устойчивость аммония выше, так как поляризуемость аммиака больше, чем у воды. Стабилизирующий фактор – взаимодействие типа монополь-наведенный диполь. Пример 2. Эффект транс-влияния. Данный эффект был рассмотрен ранее и заключается в том, что при замещении лиганда в плоских комплексах состава [MX3Y] замещение лиганда Х происходит в транс-положении. Рассмотрим комплексные ионы [MX4], [MX3Y] и [MX2Y2].
ΣΔμрез = 0 ΣΔμрез ≠ 0 ΣΔμрез ≠ 0 ΣΔμрез = 0 При вступлении в молекулу комплекса второго лиганда Y2 будет замещаться только лиганд X2, что вернет систему к состоянию когда все дипольные моменты скомпенсированы. Пример 3. Рассмотрим ряд изоэлектронных ионов металлов и их акво-комплексов [M(H2O)4]+2.
Как видно, при увеличении радиуса катиона (электростатическая характеристика) падает устойчивость комплекса, что связано с уменьшением взаимодействия типа монополь-диполь. С другой стороны, при увеличении радиуса металла падает и его поляризующее действие, что сказывается на уменьшении взаимодействия типа монополь-наведенный диполь. Пример 4. Рассмотрим устойчивость комплексов меди [Cu(NR3)4]2+ с аминами.
При уменьшении дипольного момента падает устойчивость комплексного иона, что связано с уменьшением взаимодействия монополь-диполь. Пример 5. Во многих случаях такие электростатические характеристики, как заряд центрального иона, радиусы металла и лигандов, дипольный момент не могут объяснить устойчивость соединений (или ее обращение в систематических рядах). Сравним характеристики води и аммиака: μводы = 1.84 > μаммиака = 1.46 αводы = 1.49 < αаммиака = 2.21 При взаимодействии этих лигандов с ионами двухвалентных магния (βMg+2 = 3.3) и бериллия (βBe+2 = 16) получены следующие результаты. Для магния(II) более устойчивыми являются акво-комплексы, а для бериллия(II) аммиакатные. Это связано с более высоким поляризующим действием бериллия, которое приводит к возникновению в молекуле аммиака очень большого наведенного дипольного момента, который, возможно, перекрывает постоянный диполь. То есть для комплексов магния устойчивость определяется взаимодействием ион – постоянный диполь (определяющий фактор – μ), а для комплексов бериллия устойчивость определяется взаимодействием типа ион – наведенный диполь (определяющий фактор – α и β). |