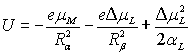|
ТЕОРИЯ СТРОЕНИЯ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ Курс лекций для студентов химфака ЮФУ (РГУ) ПОЛЯРИЗАЦИОННЫЕ ПРЕДСТАВЛЕНИЯ В ХИМИИ КС Поляризация ионов – Поляризуемость и рефракция комплексных ионов – Поляризующее действие ионов – Количественная трактовка поляризационных представлений – Применение поляризационных представлений Количественная трактовка поляризационных представлений Используя полученные представления о поляризации, поляризуемости и поляризующем действии ионов рассмотрим, к чему приводит взаимная поляризация ионов в комплексе и какой она оказывает эффект на устойчивость и строение комплекса. Δl1 Δμ1 Δμ2 Δl2
μ0 В системе, показанной выше, взаимная поляризация ионов приводит к возникновению двух индуцированных диполей Δμ1 и Δμ2 , направленных противоположно вектору постоянного дипольного момента μ0. тогда общий дипольный момент такой системы будет равен: μобщ = μ0 – Δμ1 – Δμ2 Δμ1 = α1E2= α1β2k2 Δμ2 = α2E1 = α2β1k1 Такое уменьшение дипольного момента можно трактовать, как уменьшение степени ионности и увеличение степени ковалентности связи, то есть как ее упрочнение. Ионная связь – частный случай ковалентной связи с сильной поляризацией, приводящей к полному смещению электронной пары от одного атома к другому. Эффект поляризации, таким образом, приводит к неполной передаче этой пары. Некоторая степень ковалентности ионной связи М – X согласуется с эксперименатльными данными. Так, если предположить, что в галогенидах калия связь исключительно ионная и иону упруги, то можно предположить, что заряд не дробный (q = ± 1e), а расстояние между центрами тяжести зарядов равно сумме ионных радиусов: R = R+ +R - . Тогда дипольный момент равен μ0 = 1e. Если же связи в какой то степени ковалентна, то | q| < 1e, что приводит к уменьшению общего дипольного момента, который можно найти экспериментально. Сравнение экспериментально найденного и теоретически рассчитанного дипольных моментов дает возможность оценить степень ионности (ковалентности) связи Ib. Ib = Таблица 13. Степень ионности связи в галогенидах калия.
Таким образом взаимная поляризация ионов осложняет характер взаимодействия ионов в комплексе. Рассмотрим, простейший комплекс типа [МХ]. В нем необходимо учитывать следующие виды энергии: 1. Энергия взаимодействия катиона и аниона (монополь-монополь). 2. Энергия взаимодействия аниона с дипольным моментом, наведенным им в катионе (монополь – наведенный диполь) 3. Энергия взаимодействия катиона с дипольным моментом, наведенным им в анионе (монополь – наведенный диполь) 4. Энергия взаимодействия возникших наведенных дипольных моментов (диполь – диполь). 5. Энергия, необходимая на образование индуцированных дипольных моментов. 6. Энергия отталкивания и дисперсионных сил. С учетом всех этих энергий и сил можно записать сумму шести слагаемых, каждое из которых соответствует указанным вкладам в общую энергию.
При этом предполагается, что индуцированные диполи располагаются на прямой, соединяющей центры ионов, то есть cosα = 1. Следует также отметить, что и сама величина наведенного дипольного момента Δμ есть функция от поляризуемости α и поляризующего действия и β. Δμ = αE= αβk По той же схеме проводятся расчеты энергии взаимодействия двух и более анионов с одним центральным ионом. Зная схему расчета энергии взаимодействия двух неполяризующихся ионов и то, как учитывают поляризационные поправки при таких расчетах, можно определить энергию взаимодействияия и для более сложных случаев. При этом пренебрегают членами, учитывающими поляризацию катионов, так как αкатиона << αаниона. Рассмотренные выше представления распространимы не только на комплексы с ионами, но и применимы для комплексов с нейтральными молекулами, также подверженным эффектам поляризации. При этом такие частицы уже имеют дипольный момент μ0, который меняется в результате поляризации. Энергия взаимодействия в такой системе определяется как:
где Rα – расстояние между неполяризованным металлом и лигандом; Поляризующее действие нейтральной молекулы очень мало по сравнению с поляризующим действием заряженного иона металла, поэтому центральный ион поляризуется слабо и его поляризацию можно не учитывать. Тогда можно записать:
Отметим, что Rα >Rβ >Rγ и причина этого состоит во взаимном проникновении электронных облаков частиц при их взаимной поляризации. При рассмотрении систем типа «поляризующиеся монополь-монополь» и «поляризующиеся монополь-диполь» необходимо учитывать также энергию дисперсионного взаимодействия Лондона:
|
|||||||||||||||||||||||||||
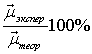
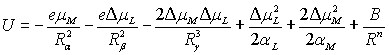 ,
,