|
ТЕОРИЯ СТРОЕНИЯ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ Курс лекций для студентов химфака ЮФУ (РГУ) ПОЛЯРИЗАЦИОННЫЕ ПРЕДСТАВЛЕНИЯ В ХИМИИ КС Поляризация ионов – Поляризуемость и рефракция комплексных ионов – Поляризующее действие ионов – Количественная трактовка поляризационных представлений – Применение поляризационных представлений Поляризуемость и рефракция комплексных ионов Поляризуемость простых даже ионов не может быть рассчитана по аддитивной схеме. Поляризуемость сложных и комплексных ионов – тем более, поскольку в них велико взаимное влияние входящих в них ионов. Однако есть разные подходы к решению этой проблемы. Один из этих подходов – подход Яншина. Согласно этому подходу поляризуемость и рефракцию таких комплексных ионов или молекул, как
следует рассматривать как сумму так называемых координативных рефракций (поляризуемостей). Для первой из указанных частиц: R = 2 R[X-M-Y] Для второй: R = R[X-M-X] + R[Y-M-Y] Причем рефракции RX-M-Y ≠ RX-M + RM-Y , включая эффект транс-влияния лигандов X и Y. Для нахождения координативной рефракции R[X-M-X] и R[Y-M-Y] можно воспользоваться соединениями содержащими только Х- или только Y-лиганды: R[X-M-X] = 1/2R([MX4]) R[Y-M-Y] = 1/2R([MY4]) Это легко сделать, установив опытные значения рефракции соединений, содержащих комплексные ионы, например, в растворе. При этом производится измерение рефракции в разбавленных растворах разной концентрации с последующей экстраполяцией на бесконечное разбавление. Так как рефракция сложной молекулы равна сумме рефракций ее составных частей, рефракцию анионов во внешней сфере противоионов вычитают из общего значения рефракции комплексного соединения Вернеровского типа (именно для них такая схем расчета рефракции применима в наибольшей степени). В таком виде аддитивная схема рефракции применима к рефракции комплексных ионов и может помочь в решении структурно-химических проблем. Таблица 11. Координативные и ионные рефракции
Воспользуемся для установления пространственного строения комплексов в кристаллическом состоянии координативными рефракциями. 1. Определяют показатель преломления n для соединения при различных длинах световой волны λ: λ1, λ2, λ3 и т.д. 2. Экстраполируют для λ = ∞, т.е. строят график n = f(λ) Если вещество анизотропно, то среднюю величину показателя преломления находят как среднее геометрическое:
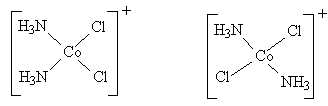
3. Вычисляют экспериментальное значение рефракции R∞ 4. Сравнивают его Rэксп с R∞, рассчитанной по координативным рефракциям. Пример. Какое строение имеет комплексный ион [Co(NH3)2Cl2]+. Он может иметь цис- и транс-строение (плоское):
(I) (II) Для I: Rрасч = 2RCl-CO-NH3 = 12,93 · 2 = 25,86 см3 Для II: Rрасч = 2RCl-CO-Cl + RNH3-CO-NH3 = 10,66+17,8=28,47 см3 Сравнение с экспериментальным значением Rэксп= 27,90 см3 дает возможность предположить структуру II. |