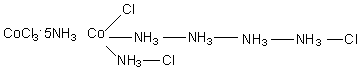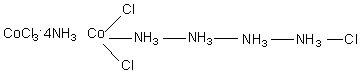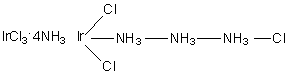|
ТЕОРИЯ СТРОЕНИЯ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ Курс лекций для студентов химфака ЮФУ (РГУ) ИСТОРИЯ КООРДИНАЦИОННОЙ ХИМИИ Первые сведения о комплексах –
Координационная теория Вернера –
Понятие комплексного соединения – Первые сведения о комплексах и методах их изучения. Первые сведения о комплексах относятся к началу XVIII века (1702 г.), когда Дисбах получил одну из первых синтетических красок, представляющую собой «смесь» цианидов калия, железа(II) и железа(III) в соотношении 1:1:1. Дисбах был торговцем красками для берлинских художников и полученная им краска была названа берлинской лазурью.. Дисбах купил у торговца необычный поташ (карбонат калия): раствор этого поташа при добавлении солей железа получался синим. При проверке поташа оказалось, что он был прокален с бычьей кровью. Краска оказалась подходящей для тканей. В 1798 году Тассэр получил новое соединение пропуская аммиак через раствор хлорида кобальта. Состав соединения СoCl3.6NH3. Факт получения индивидуального химического вещества из двух веществ с насыщенной валентностью оказался весьма примечательным и само соединение было подвергнуто изучению. Позднее были получены и другие аналогичные соединения аммиака с галогенидами металлов (таблица 1). Таблица 1. Первоначальные сведения о комплексах
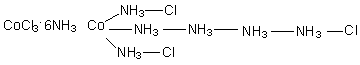
Количество осаждаемых ионов хлора легко определялось по реакции комплекса с избытком раствора азотнокислого серебра с последующим взвешиванием осадка. Первоначально свойства соединений, указанные в таблице, вызвали несколько основных вопросов: 1. Каким образом могут взаимодействовать два вещества с уже насыщенными валентностями? 2. Почему при неизменных исходных соединениях получаются конечные вещества различных составов? 3. Почему количество ионов хлора во всех соединениях одинаково, но способность к ионным реакциям обмена проявляет их лишь определенное количество? Почему комплексы обладают различной электропроводностью? (Разумеется, опыты по измерению электропроводности были проведены позже, по мере развития экспериментальных методов в химии). 4. Почему при полной идентичности состава и химических свойств возникает различие в физических свойствах (цвет) для некоторых из этих соединений? Данные, приведенные в таблице не могли быть объяснены с позиций существовавших в то время теорий и потребовались новые подходы и гипотезы. Одной из первых теорий, с позиций которой были проведены попытки ответить на некоторые вопросы была так называемая цепочная теория Бломстрандта – Йоргенсена, предложенная авторами в 1869 году. На ее авторов большое влияние оказала теория строения органических соединений М. А. Бутлерова (1861 г.), в которой существенное место имело положение о возможности атомов углерода давать цепочки различное степени протяженности и разветвленности. Поскольку в то время считалось, что любые элементы имеют одинаковый тип валентной связи, то К. Бломстрандт и С. Йоргенсен выдвинули предположение о том, что кобальт в своих соединениях имеет валентность III, в то время, как азот может проявлять две валентности: III и V. При переходе в состояние с высшей валентностью атомы азота могут образовывать цепочки, что, по мнению авторов снимало вопрос № 1. Поскольку протяженность цепочек может быть различна, количество соединений, полученных при одних и тех же исходных, может варьироваться (вопрос № 2). Для объяснения третьего вопроса авторы цепочной теории предложили считать подвижными только те ионы хлора, которые связаны с кобальтом через группы атомов азота, так как они слабее всего связаны с ионом металла. Таким образом, с позиций обсуждаемой теории строение полученных комплексов следовало представлять таким образом:
Следует отметить, что ошибочность теории была отмечена самим Йоргенсеном, который в последствии синтезировал триаммиакат хлорида иридия. В нем не осаждался ни один ион хлора: представить структуру так, чтобы все три хлора были связаны непосредственно с атомом металла не возможно с позиций обсуждаемой теории. Можно предположить, что ошибочность представлений Бломстрандта и Йоргенсена следует из самих химических представлений того времени, ведь ионы хлора, связанные непосредственно с металлом, прекрасно осаждаются уже из исходных хлоридов. Кроме того, с позиций окислительно-восстановительной теории атомы азота не могут повышать валентность (степень окисления) так как в этом случае должен быть атом, понижающий ее. Кроме того, известно, что азот не бывает пятивалентным. |