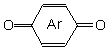|
ТЕОРИЯ СТРОЕНИЯ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ Курс лекций для студентов химфака ЮФУ (РГУ) ИСТОРИЯ КООРДИНАЦИОННОЙ ХИМИИ Первые сведения о комплексах – Координационная теория Вернера
– Понятие комплексного соединения
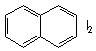
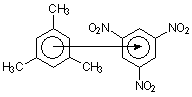
– Понятие комплексного соединения Несмотря на то, что история координационной химии насчитывает около двух веков, выработать исчерпывающее понятие координационного соединения, которое включало бы в себя все виды этих соединений, не удалось. Причины такого состояния дел следующие. 1. Прежде всего это многообразие типов координационных соединений. Координационные соединения весьма разнообразны по своей структуре, устойчивости, природе и свойствам. Если даже взглянуть на формулы этих соединений, становится ясным. Что свести их к одному определению нельзя. Рассмотрим некоторые примеры:
Это только некоторые типы комплексов. Заметно, что они кардинальным образом отличаются друг от друга строением и типологией. В связи с этим дать общее определение комплексного соединения весьма затруднительно. 2. Не существует четкой границы между простым соединением и координационным. Простейший пример – хлорид натрия. В газовой фазе он существует в виде двухчастичной молекулы с типично ионной связью между ионами хлора и натрия. Однако в кристаллическом состоянии однозарядный ион натрия окружен шестью однозарядными ионами хлора. При этом общий заряд хлора больше, чем заряд натрия и формально, координационное число натрия равно шести. Таким образом, то, является ли в данный момент соединений координационным, зависит от термодинамических условий, в которых оно находится (разумеется, не для всех типов комплексов). 3. Не существует корреляции между классификацией по природе химической связи и классификацией химических соединений. Так при взаимодействии тетраметилолова с лигандами, способными давать координационную связь в рамках одной молекулы реализуются два вида химической связи – ковалентная σ-связь и связь, образованная по донорно-акцепторному механизму.
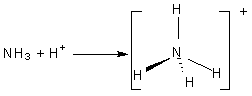
Здесь же можно привести пример для иона аммония. Как известно, одна из четырех ковалентных связей в нем образуется при «координации» протона молекулой аммиака, при этом далее все четыре связи становятся эквивалентными и не возможно выделить как особую связь, образованную по донорно-акцепторному механизму (играющему важнейшую роль при образовании координационных связей для многих типов комплексов).
|