|
ТЕОРИЯ СТРОЕНИЯ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ Курс лекций для студентов химфака ЮФУ (РГУ) ИСТОРИЯ КООРДИНАЦИОННОЙ ХИМИИ Первые сведения о комплексах – Координационная теория Вернера –
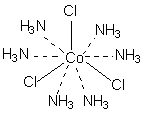
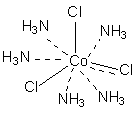
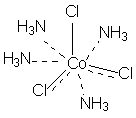
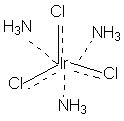
Понятие комплексного соединения – Координационная теория Вернера Теория координационных соединений, предложенная А. Вернером в 1893 году, до сих пор является основной теорией координационных соединений (для комплексов определенного вида). Рассмотрим ее основные положения. 1. Большинство элементов проявляет два типа валентности – главную и побочную. 2. Атом элемента стремится насытить не только главные, но и побочные валентности. 3. Побочные валентности атома строго фиксированы в пространстве и определяют геометрию комплекса и его различные свойства. В современной химии синонимом главной валентности является степень окисления элемента (обозначим ее сплошной линией), а побочная валентность определяется как координационное число, то есть количество атомов непосредственно связанных с металлом при насыщении его побочной валентности (обозначим ее пунктирной линией). В соответствии с изложенными представлениями Вернера строение первого из указанных в таблице 1 комплексов выглядело так, как показано ниже. Для остальных соединений стехиометрическое соотношение исходных веществ таково, что молекул аммиака не хватает для насыщения всех шести побочных валентностей и их насыщают ионы хлора. При этом хлор, насыщающий эти валентности меняет свое состояние и уже не может обмениваться в реакциях ионного обмена. Те же ионы хлора, которые насыщают только главные валентности имеют те же свойства, что и в исходном хлориде кобальта и, как и в последнем, могут замещаться или обеспечивать электропроводность комплекса.
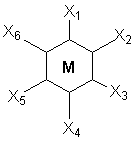
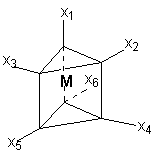
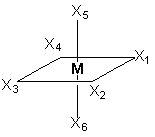
В последнем соединении все три хлора участвуют не только в насыщении главной, но и побочных валентностей. В связи с этим в нем нет «подвижных» ионов хлора и он не способен на ионные реакции и не проводит электрический ток. Главная валентность обусловлена, как уже упоминалось, степенью окисления кобальта (+3), то есть электростатическим притяжением трех однозарядных ионов хлора и одного трехзарядного иона кобальта. Побочная же валентность обусловлена так называемым явлением координации, которое, с современных позиций, может иметь различную природу. Те ионы, атомы, молекулы, которые координируются ионом металла называют лигандами; вместе с ионом металла они образуют так называемую внутреннюю координационную сферу. Не трудно заметить, что, несмотря на различие в строении комплексов, количество лигандов в каждом случае равно шести, однако в первом из соединений ни один из ионов хлора не является лигандом, так как не входит во внутреннюю координационную сферу, а образует так называемую внешнюю сферу противоионов, которая для последнего из соединений в ряду полностью отсутствует. Ионы, не входящие во внутреннюю координационную сферу, при растворении комплекса обуславливают его электропроводность. В соответствии с этим диссоциацию комплексов можно записать так: [Co(NH3)6]Cl3 ↔ [Co(NH3)6]3+ + 3Cl- [Co(NH3)5Cl]Cl2 ↔ [Co(NH3)5Cl]2+ + 2Cl- [Co(NH3)4Cl2]Cl ↔ [Co(NH3)4Cl2]+ + Cl- [Ir(NH3)3Cl3] – не диссоциирует Таким образом, первые два тезиса теории Вернера закрывают вопросы 1 – 3. Остановимся подробнее на третьем тезисе теории Вернера, а именно на том, что побочные валентности фиксированы в пространстве и определяют геометрию комплекса и его стереохимию. При координационном числе 6, возможны три способа расположения шести точек в пространстве, относительно центра координации – то есть атома металла. Это правильный шестиугольник, правильный (или искаженный) октаэдр и центрированная правильная трехгранная призма, изображенные на рисунке 1.
Рисунок 1. Возможные
фиксированные положения лигандов в
пространстве Во времена Вернера рентгено-струкутрный анализ еще не был разработан, как метод определения пространственной структуры соединений, поэтому был использован следующий «остроумный» способ определения геометрии комплексов. Он состоял в сравнении количества реально существующих изомеров комплекса (полученных при всевозможных вариациях условий синтеза) с теоретически найденным числом изомеров, возможных только исходя из предполагаемой геометрической модели. При этом варьировалось также количество различных по типу лигандов, которые мы назовем X и Y. Для шестикоординированного иона кобальта полученные результаты сведены в таблице 2. Таблица 2. Теоретически возможные и практически найденные
Обратим внимание на два обстоятельства. Во-первых, заместители типа Х заполняют оставшиеся положения в структурах и их рассмотрение опускается. Во-вторых, октаэдр является правильным, то есть любая пара лигандов, расположенных напротив друг друга может быть представлена на оси, а оставшиеся образуют «экваториальную» плоскость. Если октаэдр является искаженным (вытянутым вдоль оси четвертого порядка), то аксиальные положения отличаются от экваториальных. В этом случае количество теоретически возможных изомеров возрастет. Из таблицы можно сделать вывод, что единственным возможным пространственным строением шестикоординированного иона кобальта является октаэдрическое, так как лишь для него наблюдается полное совпадение количеств теоретических изомеров и препаративно выделенных. |
||||||||||||||||||||||||||||||||||