|
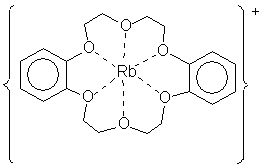
ТЕОРИЯ СТРОЕНИЯ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ Курс лекций для студентов химфака ЮФУ (РГУ) ТИПЫ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ Характерные особенности координационных соединений – Примеры комплексных соединений Примеры комплексных соединений Комплексы с краун-эфирами. Такие комплексы образуются при взаимодействии различных краун-эфиров со щелочными металлами (не переходные металлы!), имеющими, как правило, большой размер. При этом связь в них имеет промежуточный характер между донорно-акцепторной, ионной и ван-дер-ваальсовым взаимодействием. Ион металла (имеющий положительный заряд) удерживается внутри полости за счет электронных пар кислорода, направленных внутрь полости, принимающей металл.
Прочность таких комплексов определяется степенью соответствия размера полости макроцикла и радиуса катиона. Поэтому 12-краун-4 больше всего подходит для включения однозарядного иона лития; 15-краун-5 – для натрия; 18-краун-6 – для ионов калия. Когда такого соответствия нет, комплекс может образоваться, но его свойства (устойчивость, строение) будут другими. Если полость для катиона слишком мала, как, например, в случае иона K+ и 12-краун-4, возможно образование комплекса состава 2:1, в котором катион одновременно координирует две молекулы краун-эфира. Когда же макроцикл слишком велик, в его полости могут оказаться сразу два катиона, то есть будет получен комплекс состава 1:2.Однако, в любом из этих случаев прочность комплексов будет ниже, чем при оптимальном соотношении размеров катиона металла и полости краун-эфира. Клатраты.
Клатратные соединения впервые открыты Дэви в 1811 г., установившим, что хлор с водой образует твердый газовый гидрат. В XIX в. проведены первые исследования и гидратов углеводородов – метана, этана, этилена, пропана. В 1886 г. Милиус обнаружил, что гидрохинон образует комплексы с химически инертными газами – азотом, аргоном, ксеноном, криптоном, Поскольку химической связи в этом случае образоваться не могло было допущено, что комплекс образован в результате окружения одной молекулы несколькими молекулами другого компонента В 1940 г. Бенген открыл, что мочевина образует твердые аддукты с нормальными алканами и алифатическими спиртами, например с октиловым спиртом. Эти соединения также лежат на границе между комплексами и Ван-дер-ваальсовыми ассоциатами и существую только в кристаллическом состоянии. Образуются при внедрении молекул одного типа в межкристаллическое пространство другого вещества. Такое взаимодействие принято называть взаимодействием типа «гость-хозяин». Комплексы со свободными радикалами.
В данном случае образование комплекса может частично стабилизи-ровать молекулу, содержащую радикальные группы. π-Комплексы металлов.
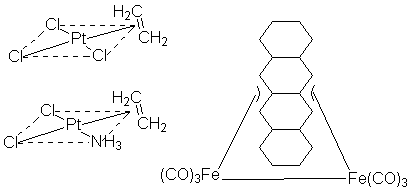
Комплексы с этиленом Комплекс с тетраценом Комплексы такого типа содержат многоцентровые орбитали. Координационная связь в таких случаях называют гапто-связью. Строение таких комплексов и их свойства трактуют с позиции теории МО. Органические π-комплексы
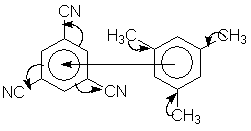
Такие комплексы образуются за счет переноса π-электронной плотности донора на акцептор. Три циано-группы акцептора за счет мезомерного эффекта отнимают часть электронной плотности кольца, вследствие чего его пи-система становится π-дефицитной. Индукционный эффект метильных групп наоборот делает π-систему симм-триметилмбензола π-избыточной. Обе эти π-системы молекул подходят по симметрии и легко перекрываются, образую координационную связь. Это пример комплекса, не содержащего ион металла-комплексообразоателя. В таких комплексах происходит перекрывание ВЗМО донора и НСМО акцептора. Их называют также комплексами с переносом заряда. К ним относятся также – комплексы ароматических соединений с галогенами, катионами серебра и ртути; 1,3,5-тринитробензолом, пикриновой кислотой, хлоранилом. Комплексы галогенов или тетрацианоэтилена с n-донорами (спиртами, простыми эфирами) или π-донорами (алкенами или алкинами), также следует рассматривать как комплексы с переносом заряда. Например, в кристаллах хингидрона молекулы хинона и гидрохинона чередуются и располагаются в двух параллельных плоскостях друг над другом. Комплексы с переносом заряда часто интенсивно окрашены. Окраска комплексов обусловлена переносом заряда от ароматического донора к акцептору, хотя степень переноса заряда невелика и редко превышает 0,1 заряда электрона. Комплексы с инертными газами. Хе[PtF6 ] Хе[RuF6 ] XeF4 XeF6 При образовании таких соединений важнейшую роль играет электроотрицательность фтора, который способен взаимодействовать с ксеноном. Карбонилы металлов.
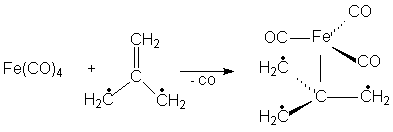
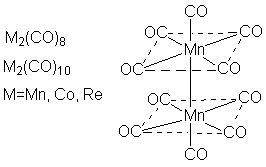
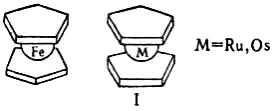
Карбонильные комплексы известны для большинства металлов VI – VIII групп. В них группы С≡О связаны с атомом металла через атомы углерода: электронная пара от атома углерода передается атому металла, образуя σ-связь, a d-электроны металла переходят на вакантные разрыхляющие π*-орбитали С≡О (π-связь). Металл координирует такое число карбонильных групп, чтобы его электронная оболочка достраивалась до оболочки стоящего за ним благородного газа. При этом С≡О является донором двух электронов, а металл находится в нулевой степени окисления (в незаряженных комплексах). Карбонилы металлов могут быть одноядерными (содержат один атом металла), (Ni(CO)4, Fe(CO)5) и многоядерными (Re2(CO)10, MnRe(CO)10, Rh6(CO)16). В многоядерных карбонильных кластерах атомы металла (или металлов) связаны между собой непосредственно и во многих случаях также с помощью мостиковых групп С≡О. Существуют ионные карбонилы карбонилметаллат-анионы ([Mn(CO)5]-, [Fe3(CO)11]) и карбонилметалл-катионы, Мn(СО)6]+. Различают гомолигандные карбонилы, содержащие в качестве лигандов только группы С≡О, и гетеролигандные (напр., карбонил-гидриды, карбонил-галогениды), которые фактически являются продуктами замещения части групп С≡О в гомолигандных комплексах на друние лиганды. Все карбонилы металлов диамагнитны, за исключением V(CO)6. Молекула Ni(CO)4 имеет конфигурацию тетраэдра, М(СО)6, где М = Сr, Mo, W, V, – октаэдра, Fe(CO)5 тригональной бипирамиды При нагревании карбонилы металлов разлагаются на СО и металл. Группы С≡О в карбонилах металлов могут замещаться на другие лиганды: фосфины, амины, изонитрилы, непредельные органические соединения, например: Сr(СО)6 + L →Cr(L)(CO)5] + CO; Fe(CO)5 + СН2=СНСН=СН2 → [Fe(η-C4H6)(CO)3] + 2СО. Карбонилы металлов окисляются кислотами, галогенами, кислородом, пероксидом водорода и др. При взаимодействии с галогенами образуются карбонил-галогениды или галогениды металлов, например: Mn2(CO)10 + Cl2 → 2[Mn(Cl)(CO)5] 2Cr(CO)6 +3Cl2 → 2CrCl3 + 12CO Многие карбонильные комплексы легко окисляются на воздухе, реагируют с щелочными металлами или с их гидроксидами, давая карбонилметаллат-анионы, например: M(CO)6 + 2Na → Na2[M(CO)5] + CO M= Cr, Mo, W Металлоцены (сэндвичевые соединения).Металлоценами называют дициклопентадиенильные соединения металлов общей формулы M(η5-С5Н5)2. Получены для большинства d-элементов. Имеют структуру "сэндвича" – металл в степени окисления +2 располагается между двумя лежащими в параллельных плоскостях циклопентадиенильными кольцами на равном расстоянии от всех атомов углерода. В большинстве соединений связь металла с лигандами ковалентна; исключение – манганоцен, где связь обусловлена электростатическим взаимодействием катиона Мn2+ с анионами (С5Н5)-. Частично ионный характер имеют также хромоцен и ванадоцен. В кристаллическом состоянии ферроцен находится в заторможенной анти-призматической конформации; рутеноцен и осмоцен – в призматической:
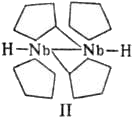
Металлоцeны проявляют ароматические свойства, в частности атом водорода замещается при действии электрофильных реагентов (сульфирование, ацилирование по Фриделю – Крафтсу, меркурирование, металлирование и др.). Устойчивость определяется тем, удовлетворяет ли электронная структура соединения правилу 18 электронов (правило эффективного атомного номера). В соответствии с ним общее количество электронов, предоставленных ионом металла и кольцевых лигандов должно быть равно 18. Такому условию удовлетворяют только металлоцены, где М= Fe, Ru, Os. Они устойчивы, как и (η6-дибензол)хром и (η5-циклопентадиенил)(η2-трикарбонил)марганец (цимантрен или ЦТМ). Ограниченно устойчив никелоцен. Остальные металлоцены на воздухе очень быстро разрушаются. С акцепторами электронов, напр. n-хлоранилом, тетрацианоэтиленом, металлоцeны образуют комплексы с переносом заряда. Большинство металлоцeны окисляется до металлоцениевых катионов [(С5Н5)2М]+ или [(С5Н5)2М]2+ , которые существуют обычно в кислых водных растворах, осаждаются в виде солей с комплексными анионами – PF6-, BF4-, PtCl62-, Ph4B- и др. Ионы кобальтоцения, родоцения и иридоцения исключительно устойчивы к действию окислителей – не разрушаются при нагревании с концентрированной азотной кислотой и царской водкой. Никелоцен легко обменивает циклопентадиенильные кольца на др. лиганды при действии разнообразных реагентов – Ni(CO)4, NO, PPh3, KCN в жидком аммиаке, CH2=CHCH2MgX, HC=CH и др. Непредельные соединения (СН3ООСС=ССООСН3, CF2=CF2 и др.) присоединяются к одному кольцу никелоцена с образованием нового лиганда, имеющего иной характер связи с атомом никеля. Кобальтоцен медленно реагирует с водой с выделением Н2. При действии на него галогенсодержащих органических соединений образуются соль кобальтоцения и нейтральные устойчивые комплексы. Металлоцeны элементов начала больших периодов электрон-дефицитны и в ряде реакций ведут себя аналогично карбенам: очень неустойчивы к окислению и нагреванию. Так, ниобоцен, полученный только в растворе, при комнатной температуре быстро превращается в биядерный комплекс:
Металлоцeны получают реакцией солей или ацетилацетонатов переходных металлов с циклопентадиенидами щелочных металлов, Mg, Tl; действием циклопентадиена на соль (в присутствии основания) или карбонила металла. При взаимодействии галогенидов некоторых металлов с C5H5Na+ образуются не металлоцeны, а их производные – галогениды или гидриды, например (C5H5)2TiCl2, (C5H5)2ReH, (C5H5)2MoH2. В таких производных кольца расположены не параллельно. Расстояния металл-кольцо сведены в таблице: Таблица 5. Свойства некоторых металлоценов.
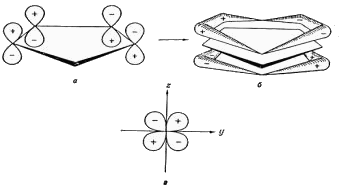
Диамагнетизм ферроцена, имеющего формально двухвалентный ион железа, который должен проявлять парамагнетизм, его ароматический характер, проявляемый в химических реакциях, объясняется с позиций своеобразия электронного перераспределения при образовании молекулы ферроцена и подобных ему металлоценов. В π-циклопентадиенильных лигандах σ-связи атомов углерода друг с другом и с атомом водорода не принимают участия в образовании связей лиганда с металлом. Анион C5H5- построен в виде плоского симметричного пятиугольника. У каждого атома углерода имеется орбиталь pz, перпендикулярная плоскости кольца. Из этих атомных pz- или 2pπ-орбиталей образуются молекулярные (МО) π-орбитали. Существует 5 таких МО, из которых три нижние по значению энергии заняты тремя парами электронов. Связь с металлом образуется за счет перекрывания заполненных МО колец с незаполненными атомными орбиталями железа; одновременно с этим заполненные орбитали железа перекрываются с незанятыми МО аниона C5H5- , осуществляя дативное (обратное) взаимодействие. На рис. 2 показаны атомные pz-орбитали четырех атомов углерода циклопентадиенильного кольца, а рис. 2б соответствует общему виду МО, образующихся за счет перекрывания атомных орбиталей. Эта одна из трех МО, заполненных электронами. На рис. 2в показана незанятая атомная dyz-орбиталь иона железа, для которой плоскость xz является узловой. МО кольца и dyz-орбиталь железа соответствуют одна другой по симметрии и могут перекрываться с образованием химической связи. Наряду с этим вакантная dzx-орбиталь железа способна перекрываться с заполненной π-МО второго кольца железа C5H5 (такой же, как МО на рис. 2б), в результате чего и образуется сэндвичевая структура.
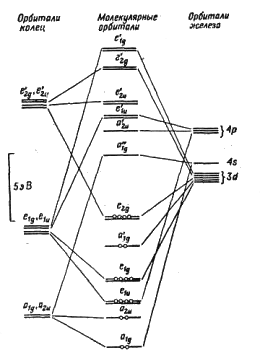
Рис. 2. Схема образования связи в π-циклопентадиенильных соединениях ферроцена с точки зрения теории МО. Полная молекулярная диаграмма ферроцена была дана в работе Дяткиной и Шустровича и приведена ниже.
Рисунок 3. Молекулярные орбитали (МО) ферроцена. Описание связей в ферроцене с помощью теории МО оказалось очень успешным, так как объясняет наблюдаемые физико-химические свойства, в частности, объясняется диамагнетизм молекулы ферроцена, т.к., согласно молекулярной диаграмме (рис. 3), неспаренных электронов не должно быть. Наблюдается хорошее совпадение рассчитанного значения ионизационного потенциала 6,39 эВ с экспериментальным 6-8 эВ. Рассчитанное значение положительного заряда на атоме железа (+0.7) сопоставимо с величиной (+0.4), полученной на основании изучения К-края поглощения рентгеновских лучей. Такое электронное строение также соответствует химическому поведению металлоценов, т.е. согласуется с той легкостью, с которой многие металлоцены вступают в реакцию электрофильного замещения атома водорода циклопентадиенильных колец. Кроме того, магнитные измерения металлоценов также подтверждают теоретические предсказания об электронном распределении в них. Измеряемая величина магнитной восприимчивости соответствует числу неспаренных электронов в комплексе, а различия между «чисто спиновыми» и экспериментальным значениями магнитного момента указывают на вклад орбитальной составляющей. Например, если неспаренный электрон находится на орбиталях, магнитное квантовое число которых равно нулю (m = 0, т.е. на орбиталях 4S, 4pz и 3dz2), то орбитальная составляющая магнитного момента равна нулю. Однако если неспаренный электрон находится на орбитали dx2-y2 или dxy (ml =±1, ±2), то он имеет орбитальную составляющую, отличную от нуля, и, следовательно, наблюдаемый магнитный момент больше «чисто спинового» значения. Наконец, если имеется по одному неспаренному электрону одновременно на орбиталях dx2-y2 и dxy, то вклад орбитальной составляющей в величину магнитного момента снова равен нулю. Подобный подход лежит в основе описания электронного строения бис-π-циклопентадиенильных комплексов переходных металлов 3d-ряда. Таблица 6. Данные магнитных измерений и заполнение электронами высших орбиталей в бис-η5-циклопентадиенильных комплексах.
* Cp2 = (π-C5H5)2 Химия металлоценов и их производных и в настоящее время бурно развивается. Металлоцeны нашли широкое применение как катализаторы и сокатализаторы в гомогенных каталитических реакциях, лекарственные препараты, присадки к топливам и маслам, промежуточные продукты в органическом синтезе. Сами координационные соединения могут выступать в качестве лигандов, если в их структуре есть некоординированные гетероатомы, способные давать координационную связь с другим вступающим в молекулу металлом. В этом случае получают так называемые би- и полиметаллические соединения. Если металлы одинаковы, то их называют гомополиядерными, если разные, то гетерополиядерным. Такие соединения называют еще сверхкоординационными или комплексами комплексов. 5. Следующей особенностью координационных соединений является то, что они существенно отличаются друг от друга по устойчивости и по типу связывания. Так различают комплексы в которых связь металл-лиганд осуществляется за счет электростатических сил, и комплексы, имеющие прямое ковалентное связывание за счет донорно-акцепторного взаимодействия. Следует иметь в виду, что чаще всего связь может иметь промежуточный характер между двумя указанными. Во времена Вернера считалось, что комплексы образуют только переходные металлы (то есть, с частично заполненными d-оболочками). Эти комплексы принять называть вернеровскими. Однако в настоящее время описаны комплексы со многими щелочными, щелочноземельными и непереходными металлами (то есть с теми металлами, у которых d-орбитали полностью заполнены или вовсе отсутствуют). Получены также комплексы с анионами (PF6- , BF4-) и неметаллами. Первые обычно окрашены, кинетически инертны и более прочны в случае комплексообразования с S- и P-донорами. Вторые – не окрашены, весьма лабильны и более прочны в случае О- и N-доноров. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||