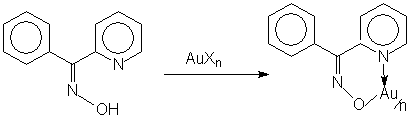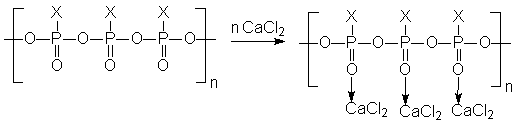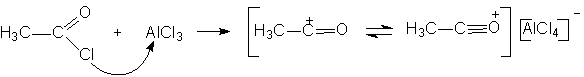|
ТЕОРИЯ СТРОЕНИЯ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ Курс лекций для студентов химфака ЮФУ (РГУ) НАЗВАНИЕ ГЛАВЫ Значение для химической теории – Практическое применение координационных соединений Практическое применение координационных соединений. 1. Аналитические реагенты. Большинство аналитических методик опирается на реакцию комплексообразования. При этом либо сами аналитические реагенты являются комплексами (реактив Несслера, гексацианноферраты и гексацианоферриты калия и проч.), либо анализируемый объект в начале переводится в комплекс, а затем происходит его количественное определение, связанное с применением различных химических и физических методов. Применение комплексообразования в аналитической химии основано на кардинальном изменении свойств анализируемого объекта, среди которых: ▪ Растворимость (экстракция и выделение, гравиметрия). ▪ Окислительно-восстановительные свойства. (ОВ-титрование). ▪ Величина заряда иона, то есть электрические свойства (кулонометрия, полярография). ▪ Изменение окраски (фотометрия, спектрометрия). 2. Металлургическая промышленность. Комплексообразование при-меняют для разделения и очистки металлов, в особенности ценных. Известно, например, что золото извлекают через цианидный комплекс. Применение координационной экстракции дает следующие преимущества технологических процессов: ▪ Непрерывность экстракции ▪ Простота аппаратурного оформления ▪ Компактность аппаратуры ▪ Бесшумность (так как работа производится с жидкостями) ▪ Возможность разделения трудноразделяемых металлов, например, Zr/Hf, Ta/Nb, лантаноиды и актиноиды. ▪ Высокая чистота получаемых продуктов. ▪ Возможность работы с радиоактивными металлами – ураном, торием, плутонием. При этом используются такие лиганды, как бутилфосфат, (С4Н9О)3РО, (С8Н15)РО, дипиридил, (С4Н9О)3N→O. Следует отметить, что экстрагент подбирается в основном практическим подбором, так как теория в данной области еще не разработана.
Часто при экстракции использую образование ВКС. В этих случаях в качестве экстрагирующих реагентов применяются органические соединения, содержащие две или более электроно-донорные группы. Такая реакция характеризуется чрезвычайно высокой избирательностью, позволяя выделять только трехвалентное золото. 3. Ионообменные смолы. При очистке воды используют полимерные лиганды, образующие хелаты с заданным ионом:
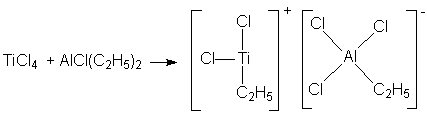
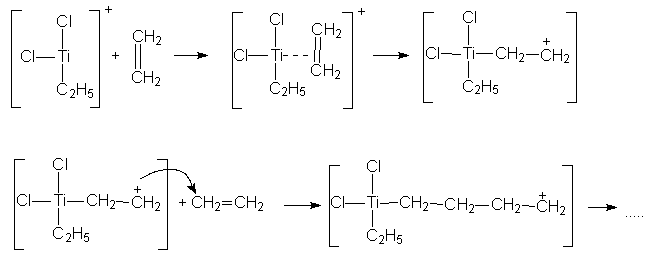
В таких ионообменных смолах участвуют не только электростатические силы, но и донорно-акцепторное связывание, что приводит к повышению значений констант обмена и селективности ионитов. Некоторые из таких ионитов включают полифосфаты и полиаминокислоты, являющиеся основой животных и растительных белков. 4. Электролитическое осаждение металлов. В случае прямого электролитического осаждения металлов из их простых солей (например, никелирование, хромирование) покрытие получается рыхлым и лишенным каких-то потребительских качеств. В случае использования источника металла координационных соединений удается существенно повысить прочность и плотность осадков, что, в свою очередь, повышает их защитные свойства. Однако, в настоящее время состав электролитических Ван подбирается в основном эмпирическим путем. Новым направлением в этой области является осаждение металлов из неводных сред и получение сплавов электролизом. 5. Катализаторы органического синтеза. Комплексные соединения имеют огромное значение в каталитических процессах и технологиях: органический синтез, полимеризация, поликонденсация, алкилирование, ацилирование и проч. Разберем несколько примеров. А) Катализаторы полимеризации. Циглер и Натта установили, что с помощью комплексных соединений тетрахлорида титана с алкилгалогенидами (TiCl4.AlCln(Alk)m m=2,3; n+m=3) можно получать полиэтилен с высоким молекулярным весом. При этом применение катализаторов Циглера – Натта дает следующие преимущества: ▪ Универсальность (катализируются процессы полимеризации практически всех непредельных углеводородов). ▪ Стереоспецифичность. ▪ Возможность проведение реакции при низких температурах и давлении, что удешевляет продукт. Механизм действия катализаторов выглядит так:
Катионная часть комплекса способна к дальнейшему координации-онному взаимодействию с олефином по схеме:
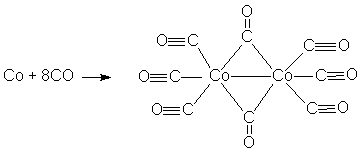
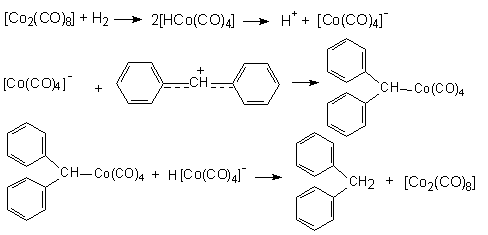
Максимальной каталитической активностью обладают комплексы хлоридов титана, циркония, гафния, урана, тория. При этом на металле получают формальный заряд +3, то металл принимает конфигурацию d1 для Ti, Zr, Hf. Б) Катализаторы гидрирования (присоединение Н2) и карбонилиро-вания (присоединение СО) непредельных соединений. При этом в качестве катализаторов применяются карбонильные комплексы [Co2(CO)8] и [HCo(CO)4].
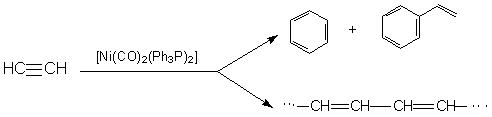
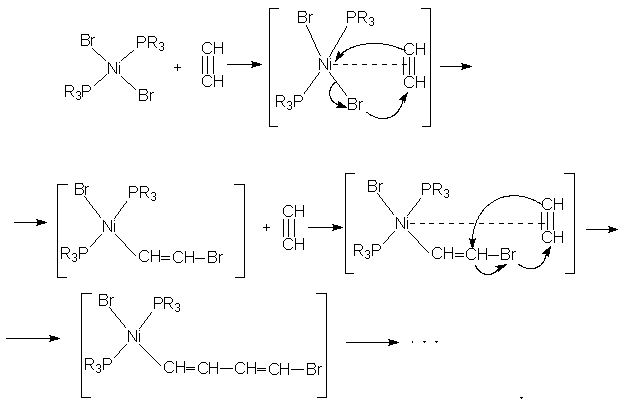
Карбонилфосфиновые комплексы никеля являются хорошими катализаторами при процессах циклотримеризации и линейной полимеризации ацетилена и его замещенных производных:
Каталитическая активность атома Ni и характер образующихся продуктов зависят от природы связанных с металлом лигандов. Для [Ni(CO)n(Ph3P)m] n+m = 4 (координационное число), при n = 0, 1 каталитическая активность не наблюдается. В качестве катализатора линейной полимеризации применяют [Ni(CO)2((СH3СH2N)3P)2]. Рассмотрим механизм полимеризации ацетилена, катализируемого комплексом бромида никеля с фосфинами:
При изучении этой реакции бром обнаруживался в промежуточных продуктах. Для той же цели используются катализаторы на основе хелатов никеля в растворе пиридина. В) Ацилирование и алкилирование. В реакции Фриделя – Крафтса в качестве катализатора используют комплекс алюминия. Как известно, реагентом служит смесь ацилирующего агента (ацетилхлорид, уксусный ангидрид) и безводного хлорида алюминия в хлороформе или хлористом метилене:
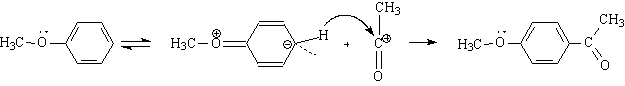
Дальнейшую роль играет катион:
Комплексные соединения и сами реакции комплексообразования играют большую роль других реакциях органического синтеза: ▪ Карбонилирования непредельных соединений; ▪ Гидратация непредельных соединений; ▪ Каталитическое окисление углеводородов в присутствии солей Со+2. ▪ Дегидрирование в присутствии солей Pt+2 6. Рабочие материалы в лазерной технике. Координационные соединения (точнее, их концентрированные растворы) могут применяться как рабочие материалы в лазерной технике. Например, в качестве таковых нашли широкое использование β-дикетонаты лантаноидов (Еu, Lu, Er). Появление этой области применения комплексов редко-земельных элементов способствовало всплеску интереса к ним. Изучаются их оптические, электрические и другие свойства как в рвстворе, так и в поликристаллическом состоянии. Они также используются в ядерной технике для термоэлектрического преобразования энергии. 7. Соединения со специальные свойства. Многие комплексы обладают специальными свойствами и могут служить в качестве полупроводников:
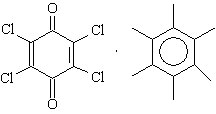
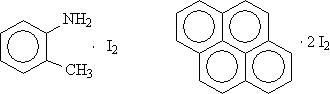
гексаметилбензол - хлоранил Комплексы с молекулярным иодом:
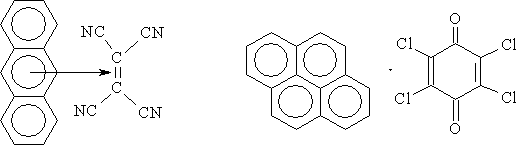
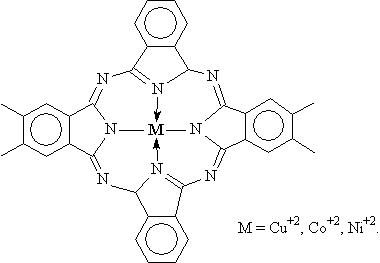
п-толуидин-Иод Пирен-Иод Органические π-комплексы: Антрацен – Тетрацианоэтилен Пирен – хлоранил Поли- фталоцианиды переходных металлов:
Дитиоамидаты металлов (производные щавелевой кислоты):
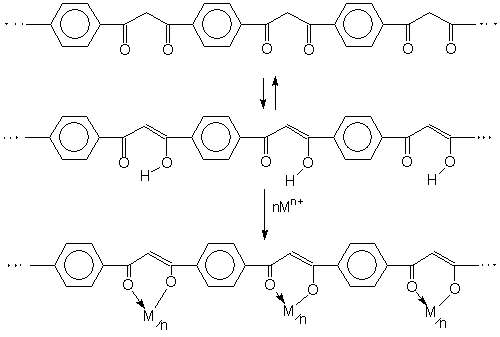
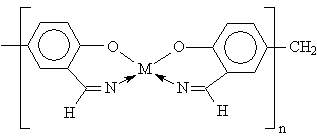
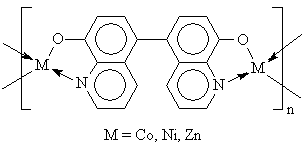
Такие комплексы при температуре 1-3 К переходят в сверхпроводящее состояние. 8. Природные соединения. Координационные соединения распространены в природе. Например: ▪ Гемоглобин – это ВКС железа. ▪ Хлорофилл – ВКС магния. ▪ Инсулин – комплекс цинка С254H337N65O75S6Zn. ▪ Витамин В12 – комплекс железа и кобальта. Он ответственен в организме за синтез гемоглобина. При его отсутствии наблюдается малокровие. 9. Лекарственные препараты. Комплексные соединения используются в качестве лекарственных препаратов, стимуляторов роста, пищевых добавок, в том числе к кормам. Например комплексы платины ( например [A2PtX2], где А = NH3, X = Cl) обладают антираковой активностью. 10. Материалы с особыми свойствами (электрическими, магнитными, оптическими). В особенности интересны металлополимеры, например:
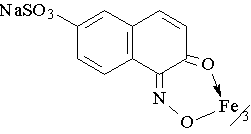
11. Красители. Пример: нафтоловый зеленый.
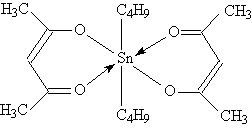
12. Стабилизаторы полимеров: например, ацетиацетонат дитретбутил-олова.
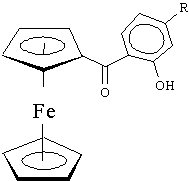
13. Термо- и светостабилизаторы – компоненты, без которых невозможно развитие космической техники. Они защищают поверхность космических кораблей от излучения. Пример – комплекс железа. Производное ферроцена:
|