|
ПРАКТИКУМ ПО ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ ХИМИИ для студентов биолого-почвенного факультета
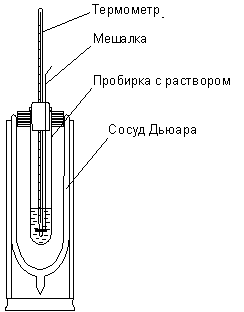
Работа № 1 Задания к работе 1. Изучить зависимость температуры от времени в ходе калориметрических процессов. Построить графики зависимостей, графически определить изменение температуры. 2. Определить постоянную калориметра (теплоемкость калориметрической системы). 3. Определить удельную теплоту растворения неизвестной соли. 4. Рассчитать относительную ошибку определения, используя табличные значения определяемых величин. В качестве калориметра применяется сосуд Дьюара, в который вставлена широкая пробирка, закрытая пробкой с отверстиями для термометра и мешалки (см. рис.). В основе определения тепловых эффектов калориметрическим методом лежит уравнение (1):
Здесь ΔН
- суммарный тепловой эффект проводимого в калориметре процесса; Теплоёмкость калориметрической системы (постоянную калориметра) определяют, проводя в калориметре процесс, тепловой эффект которого точно известен. В нашем случае в качестве эталона используется химически чистый хлорид калия, зависимость удельной теплоты растворения которого от температуры в интервале 10 - 30 °С имеет следующий вид: ΔНt = 79.9 – 0.924 t, кал/г (2) здесь t - средняя температура опыта tср = 0,5 (t1 + t2), °С
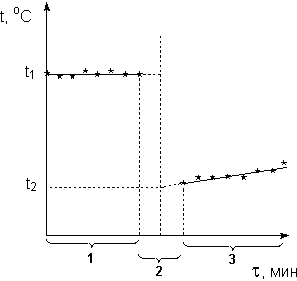
Включив секундомер и равномерно помешивая содержимое калориметра мешалкой, в течении четырех минут каждые 30 с фиксируют температуру воды (температура может оставаться постоянной либо равномерно изменяться в зависимости от соотношения температур калориметра и окружающей среды). После этого, не выключая секундомер, быстро вносят в реакционную пробирку навеску хлорида калия и интенсивно перемешивают содержимое для полного растворения соли. Через 2 мин после внесения КСl (с момента времени τ = 6 мин) вновь начинают производить снятие показаний термометра каждые 30 с ещё в течение 4 мин. Для расчета изменения температуры в процессе растворения КСl строят на миллиметровой бумаге график зависимости температуры от времени (рис.1).
1 - предварительный период;
Рисунок
1. Графическое определение изменения температуры
Найденные величины подставляются в формулу (3):
Здесь ΔН - удельная теплота растворения КСl при температуре tср
= 0,5(t1 + t2), кал/г;
Для определения удельной теплоты растворения неизвестной соли, полученной у лаборанта, проводится опыт, аналогичный описанному выше, только вместо хлорида калия берется навеска неизвестной соли массой 2.5 г, которую растворяют в 100 мл воды. Изменение температуры Δt в ходе процесса растворения определяется графически, постоянная калориметра К определена в предыдущем опыте. По формуле (4) вычисляют величину удельной теплоты растворения неизвестной соли при средней температуре опыта:
Здесь ΔН - удельная теплота растворения неизвестной соли;
Здесь ΔНэксп и ΔНтабл - экспериментально найденная и табличная величины удельной теплоты растворения соли соответственно.
№ 1. Калориметрическое определение теплоты растворения № 2. Определение константы скорости и энергии активации реакции № 3. Измерение ЭДС гальванического элемента № 4. Потенциометрическое определение рН растворов № 5. Определение поверхностного натяжения растворов ПАВ № 6. Изучение адсорбции уксусной кислоты на активированном угле № 7. Получение коллоидных растворов. Определение порога коагуляции № 8. Определение электрокинетического потенциала золя Copyright © С. И. Левченков, 2006. |