|
ПРАКТИКУМ ПО ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ ХИМИИ для студентов биолого-почвенного факультета Работа № 2 Задания к работе 1. Изучить кинетику реакции гидролиза этилацетата методом отбора проб при двух температурах. 2. Определить графическим и аналитическим методами среднюю константу скорости реакции при каждой температуре. 3. Рассчитать температурный коэффициент константы скорости и энергию активации реакции. Описание работы Гидролиз этилацетата протекает следующим образом: СН3СООС2Н5 + Н2О
В нашем случае реакция проводится в присутствии соляной кислоты, что значительно увеличивает скорость реакции. По мере протекания реакции гидролиза концентрация ионов водорода в реакционной смеси увеличивается; скорость реакции определяют, оттитровывая пробы через некоторые промежутки времени. В две пронумерованные чистые сухие колбы емкостью 100 мл наливают по 50 мл 0.2 M раствора соляной кислоты; колбы помещают в термостаты с указанной преподавателем температурой (например, колба № 1 - 25 °С, колба № 2 - 30 °С). После того, как растворы примут температуру термостата (через 10-15 минут), к ним приливают по 5 мл этилацетата и, перемешав содержимое колбы, немедленно отбирают пипеткой пробу объемом 2 мл. Момент отбора первой пробы считают началом реакции. Добавление этилацетата в колбу № 2 производят через 5-10 минут после начала реакции в колбе № 1. Взятую пробу выливают в колбу с 40 - 50 мл предварительно охлажденной дистиллированной воды (t от 0 до 2 °С) для торможения реакции и титруют 0.05 н. раствором NаОН с фенолфталеином до появления устойчивого слабо-розового окрашивания. Следующие пробы отбирают через 15, 30, 45, 60 и 75 минут после начала реакции. Титрование первой пробы позволяет определить концентрацию соляной кислоты в реакционной смеси. Для определения исходной концентрации этилацетата необходимо оттитровать пробу, взятую после окончания реакции. Для ускорения реакции гидролиза эфира одну из колб после отбора последней пробы нагревают с обратным холодильником на водяной бане при температуре 70 - 80 °С в течении 30 минут и, охладив раствор, титруют пробу объемом 2 мл. Константы скорости для каждого момента времени вычисляют по формуле (1) и затем находят среднее значение:
Здесь t - время от начала реакции, мин; Таблица 1
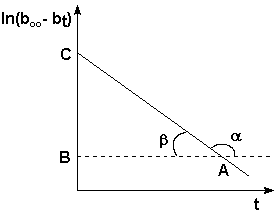
Нанеся экспериментальные точки на график в координатах время t (ось абсцисс) – ln(bоо– bt) (ось ординат), получаем прямую, не проходящую через начало координат (рис. 1). Рисунок 1. Графическое определение константы скорости.
Обратите внимание, что тангенс угла β рассчитывают как отношение длины противолежащего катета [ВС] к длине прилежащего [ВА] в прямоугольном треугольнике АВС. Длины катетов берутся в единицах масштаба осей координат. Определив константы скорости реакции при двух температурах, по формулам (4) и (5) рассчитывают температурный коэффициент скорости химической реакции γ и энергию активации:
Здесь k1 и k2 - константы скорости при температурах Т1 и Т2 соответственно; № 1. Калориметрическое определение теплоты растворения № 2. Определение константы скорости и энергии активации реакции № 3. Измерение ЭДС гальванического элемента № 4. Потенциометрическое определение рН растворов № 5. Определение поверхностного натяжения растворов ПАВ № 6. Изучение адсорбции уксусной кислоты на активированном угле № 7. Получение коллоидных растворов. Определение порога коагуляции № 8. Определение электрокинетического потенциала золя Copyright © С. И. Левченков, 2006. |