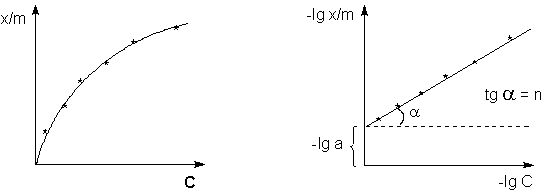|
ПРАКТИКУМ ПО ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ ХИМИИ для студентов биолого-почвенного факультета Работа № 6 Задания к работе 1. Приготовить серию растворов уксусной кислоты с заданными концентрациями. 2. Определить равновесную концентрацию при адсорбции на активированном угле для каждого из растворов. 3. Построить графики изотермы адсорбции в обычных и логарифмических координатах. 4. Определить коэффициенты уравнения Фрейндлиха.
В шести пронумерованных конических колбах объемом 250 мл разбавлением 0.8 М раствора уксусной кислоты готовят рабочие растворы СН3СООН в соответствии с указанным преподавателем номером задания (табл. 1). Для приготовления растворов при помощи мерного цилиндра (с точностью до 1 мл) наливают в каждую колбу рассчитанное по формуле (1) количество 0.8 М раствора уксусной кислоты и доливают необходимое количество дистиллированной воды.
Здесь Сx и Vx - концентрация и объем приготовляемого раствора;
Здесь Сщел и Vщел - концентрация и объем раствора щелочи, затраченного на титрование пробы; В каждую из колб со 100 мл раствора вносят указанное преподавателем количество растертого в ступке активированного угля, энергично перемешивают и оставляют на 30 минут, в течении которых содержимое колб периодически взбалтывают (это время можно использовать для титрования отобранных проб). По истечении получаса растворы профильтровывают через складчатые фильтры (первую порцию фильтрата необходимо отбросить, чтобы устранить погрешность, вносимую адсорбцией кислоты на фильтровальной бумаге и разбавлением раствора остающимися в колбе каплями воды). Из фильтрата отбирают пробы такого же объема, что и ранее, титруют их раствором щелочи и рассчитывают концентрацию растворов кислоты после адсорбции. По формуле (6.3) вычисляют х - количество миллимолей уксусной кислоты, адсорбированной активированным углем и рассчитывают величину удельной адсорбции x/m (m - масса активированного угля) для каждого из растворов.
Здесь Со - концентрация исходного раствора;
После логарифмирования выражения (4) получается линейная функция (5):
Для определения коэффициентов в эмпирическом уравнении Фрейндлиха (4) строят изотерму адсорбции в логарифмических координатах (рис. 2). При этом отрезок, отсекаемый на оси ординат, равен lg a, а тангенс угла наклона прямой к оси абсцисс - показателю степени n.
Copyright © С. И. Левченков, 2006. |
||||||||||||||||||||||||||||||||||||||||||||