|
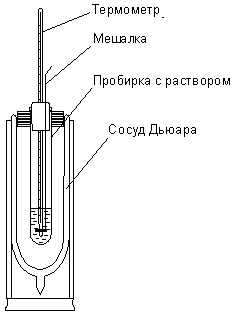
ПРАКТИКУМ ПО ФИЗИЧЕСКОЙ ХИМИИ для студентов химического факультета Работа № 1 Задания к работе 1. Изучить зависимость температуры от времени в ходе калориметрических процессов. Построить графики зависимостей, графически определить изменение температуры. 2. Определить постоянную калориметра (теплоемкость калориметрической системы). 3. Определить удельную теплоту растворения неизвестной соли. 4. Определить удельную теплоту гидратации безводного сульфата меди. 5. Рассчитать относительную ошибку определения, используя табличные значения определяемых величин. Рассчитать предельную погрешность метода и сравнить полученные значения. В качестве калориметра применяется сосуд Дьюара, в который вставлена широкая пробирка, закрытая пробкой с отверстиями для термометра и мешалки. В основе определения тепловых эффектов калориметрическим методом лежит уравнение (1):
где ΔН
– общий тепловой эффект проводимого в калориметре процесса;
Постоянную калориметра (теплоёмкость калориметрической системы) определяют, проводя в калориметре процесс, тепловой эффект которого точно известен. В нашем случае в качестве эталона используется химически чистый хлорид калия, зависимость удельной теплоты растворения которого от температуры в интервале от 10 до 30 °С имеет следующий вид: ΔНt = 79.9 – 0.924·t, кал/г (здесь t – средняя температура опыта tср = 0,5(t1 + t2), °С).
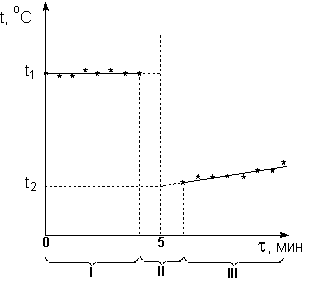
Включив секундомер и равномерно помешивая содержимое калориметра мешалкой, в течении четырех минут каждые 30 с фиксируют температуру воды (температура может оставаться постоянной либо равномерно изменяться в зависимости от соотношения температур калориметра и окружающей среды). После этого, не выключая секундомер, быстро вносят в реакционную пробирку навеску хлорида калия и интенсивно перемешивают содержимое для полного растворения соли. Через 2 мин после внесения КСl (с момента времени
τ = 6 мин) вновь начинают производить снятие показаний термометра каждые 30 с ещё в течение 4 мин.
I - предварительный период;
Рисунок 1. Графическое определение изменения температуры
Найденные величины подставляются в формулу (2):
где ΔН
– удельная теплота растворения КСl при температуре tср =
0,5(t1 + t2), кал/г;
Для определения удельной теплоты растворения неизвестной соли, полученной у лаборанта, проводится опыт, аналогичный описанному выше, только вместо КСl берется навеска неизвестной соли массой 2.5 г, которую растворяют в 100 мл воды. Изменение температуры Δt в ходе процесса растворения определяется графически, постоянная калориметра К определена в предыдущем опыте. По формуле (3) вычисляют величину удельной теплоты растворения неизвестной соли при средней температуре опыта:
где ΔН – удельная теплота растворения неизвестной соли;
Здесь ΔНэксп и ΔНтабл – экспериментально найденная и табличная величины удельной теплоты растворения соли соответственно.
Определяют аналогичным образом удельные теплоты растворения медного купороса СuSО4·5Н2О и безводного сульфата меди СuSО4. Разность теплот растворения безводной соли и кристаллогидрата будет равна теплоте гидратообразования:
Поскольку в настоящей работе определяется интегральная теплота растворения, количества воды, безводной соли и кристаллогидрата необходимо подбирать таким образом, чтобы концентрация СuSО4 в обоих образующихся растворах была одинаковой. Для определения теплоты растворения кристаллогидрата навеску медного купороса массой 2.5 г растворяют в 99.1 г дистиллированной воды (0.9 г воды содержится в кристаллогидрате). Для определения теплоты растворения безводного сульфата меди в 100 г воды растворяют навеску СuSО4 массой 1.6 г. Для расчета предельной относительной погрешности метода δ(ΔН)п рассчитывают предельные относительные погрешности определения всех величин, используемых для расчета К и ΔН. Относительную погрешность используемой для расчёта постоянной калориметра величины удельной теплоты растворения КСl считают пренебрежимо малой. В выражения (6, 7) для расчета предельной относительной погрешности определения постоянной калориметра δКп и теплоты растворения δ(ΔН)п в качестве слагаемых должна входить также и относительная погрешность определения объема воды. В качестве абсолютной погрешности определения непосредственно измеряемых величин (объема, массы и температуры) используют приборную погрешность измерения (ΔVп, Δmп и Δtп соответственно); при этом предельная абсолютная погрешность определения разности температур равна удвоенной приборной погрешности используемого термометра.
Здесь mэ и m – масса навески хлорида калия и неизвестной соли; № 1. Калориметрическое определение теплоты растворения № 2. Калориметрическое определение теплоты нейтрализации № 3. Изучение равновесия гомогенной химической реакции в растворе № 4. Градуировка термопары № 5. Построение диаграммы плавкости двухкомпонентной системы № 6. Определения коэффициента распределения вещества между двумя жидкими фазами № 7. Изучение равновесия жидкий раствор – пар в бинарных системах № 8. Определение молекулярной массы растворенного вещества криоскопическим методом № 9. Определение степени диссоциации электролита криоскопическим методом № 10. Определение константы скорости гидролиза сахарозы № 11. Определение константы скорости и энергии активации реакции иодирования ацетона № 12. Определение константы скорости и энергии активации реакции гидролиза уксусного ангидрида № 13. Определение молярной рефракции вещества © Кафедра физической и коллоидной химии ЮФУ (РГУ) |
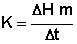 , кал/град
(2)
, кал/град
(2)