|
ПРАКТИКУМ ПО ФИЗИЧЕСКОЙ ХИМИИ для студентов химического факультета Работа № 12 Задания к работе 1. Изучить кинетику реакции гидролиза ангидрида уксусной кислоты кондуктометрическим методом при трех температурах. 2. Определить графическим и аналитическим методами среднюю константу скорости реакции при каждой температуре. 3. Рассчитать температурный коэффициент константы скорости и энергию активации реакции. 4. Построить график зависимости логарифма константы скорости реакции от обратной температуры и определить энергию активации графическим методом. Реакция гидролиза уксусного ангидрида протекает в соответствие со следующим уравнением:
Данная реакция является элементарным бимолекулярным процессом; при проведении реакции в ацетоне или уксусной кислоте кинетическое уравнение реакции является уравнением второго порядка:
Здесь СУА и СВ – концентрации уксусного ангидрида и воды соответственно; Однако при проведении реакции в большом избытке воды концентрация воды в ходе реакции практически не изменяется и может быть включена в константу скорости; мы имеем дело с реакцией так называемого псевдопервого порядка.
Константа скорости реакции может быть рассчитана по следующему уравнению:
Здесь Со – начальная концентрация уксусного ангидрида; Для контроля за ходом реакции в данном случае используется кондуктометрический метод. По мере протекания реакции электропроводность реакционной смеси возрастает вследствие диссоциации образующейся уксусной кислоты. Поэтому скорость реакции в данном случае удобнее выражать как изменение во времени концентрации продукта реакции – уксусной кислоты. Принимая, что измеряемое в ходе опыта сопротивление раствора обратно пропорционально концентрации уксусной кислоты, для расчёта константы скорости реакции можно воспользоваться следующим уравнением:
Здесь Rо – сопротивление раствора в момент начала реакции;
Измерение электрического сопротивления реакционной смеси производится на нестандартной установке, изготовленной на кафедре физической и коллоидной химии. Установка состоит из ячейки с платиновыми электродами, измерительного блока и цифрового вольтметра. Действие установки основано на непрерывном измерении сопротивления, оказываемого исследуемым раствором переменному току звуковой частоты; величина сопротивления (в омах) отображается на вольтметре. Необходимости в калибровке установки при помощи стандартного раствора при выполнении данной работы нет. Для измерения электропроводности исследуемый раствор помещается в ячейку (электроды должны быть полностью погружены в жидкость), после чего переключатель "калибровка – измерение" на измерительном блоке переводится в положение "измерение". После завершения измерений ячейку многократно ополаскивают дистиллированной водой; при хранении ячейки электроды должны быть покрыты дистиллированной водой. В ходе выполнения работы проводятся два опыта: первый при комнатной температуре, второй – при температуре 25-40 °С. В две сухие мерные колбы на 25 мл помещают с помощью пипетки по 1-2 мл уксусного ангидрида; колбы плотно закрывают. Одну из колб с уксусным ангидридом и ещё одну колбу с 50 мл дистиллированной воды помещают в установленный на заданную температуру (25-40 °С) термостат. Первым проводят опыт при комнатной температуре. Колбу с уксусным ангидридом доливают до метки дистиллированной водой комнатной температуры, быстро и энергично перемешивают содержимое, тотчас же наливают смесь в измерительную ячейку и через 30 секунд после перемешивания смеси считывают первое показание сопротивления смеси. Запись показаний прибора в первом опыте производят через каждые 30 секунд в течение 5 – 7 минут. Начальное значение сопротивления (Ro) определяют графической экстраполяцией полученной зависимости электрического сопротивления смеси от времени на момент времени τ = 0. После завершения опыта реакционную смесь выливают в сливную склянку под тягой, ячейку тщательно ополаскивают дистиллированной водой и помещают в термостат, выставленный ранее на температуру следующего опыта. Аналогичным образом проводят второй опыт. После считывания показаний в течение 5 – 7 минут прибор оставляют включённым ещё на 10 минут, после чего записывают последнее значение сопротивления Roo, которое принимают одинаковым для обоих опытов. Константу скорости реакции рассчитывают по уравнению (4) для каждого момента времени, после чего находят её среднее значение для каждого из опытов. Используя средние значения констант скорости реакции при двух различных температурах, находят по формуле (3) величину энергии активации реакции:
Результаты опытов представляют в виде следующей таблицы:
№ 1. Калориметрическое определение теплоты растворения № 2. Калориметрическое определение теплоты нейтрализации № 3. Изучение равновесия гомогенной химической реакции в растворе № 4. Градуировка термопары № 5. Построение диаграммы плавкости двухкомпонентной системы № 6. Определения коэффициента распределения вещества между двумя жидкими фазами № 7. Изучение равновесия жидкий раствор – пар в бинарных системах № 8. Определение молекулярной массы растворенного вещества криоскопическим методом № 9. Определение степени диссоциации электролита криоскопическим методом № 10. Определение константы скорости гидролиза сахарозы № 11. Определение константы скорости и энергии активации реакции иодирования ацетона № 12. Определение константы скорости и энергии активации реакции гидролиза уксусного ангидрида № 13. Определение молярной рефракции вещества © Кафедра физической и коллоидной химии ЮФУ (РГУ) |
|||||||||||||||||||||||||||||||||||||
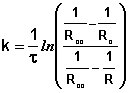 (4)
(4)