|
ПРАКТИКУМ ПО ФИЗИЧЕСКОЙ ХИМИИ для студентов химического факультета
Работа № 2 Задания к работе 1. Изучить зависимость температуры от времени в ходе калориметрических процессов. Построить графики зависимостей, графически определить изменение температуры. 2. Произвести сравнение (компарирование) термометров в необходимом интервале температур; построить график зависимости показаний термометров от времени в ходе компарирования. В случае необходимости исправить показания термометра, используемого для измерения температуры раствора щелочи. 3. Рассчитать молярную теплоту нейтрализации. 4. Рассчитать относительную ошибку определения и предельную погрешность метода; сравнить полученные величины. Молярную теплоту нейтрализации кислоты щелочью определяют по изменению температуры в процессе нейтрализации в калориметре раствора кислоты небольшим избытком раствора щелочи.
Постоянную калориметра (теплоёмкость калориметрической системы) определяют по стандартному веществу (КСl) аналогично описанному в работе 1.
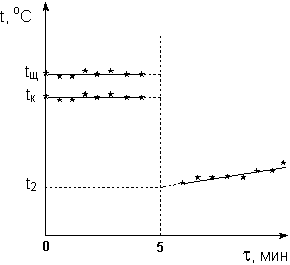
В калориметр, постоянная которого определена ранее, помещают 48 мл 0.25 н раствора соляной кислоты (или другой кислоты по указанию преподавателя). Во второй калориметр наливают 52 мл 0.25 н раствора NаОН; небольшой избыток щелочи необходим для того, чтобы при сливании растворов произошла полная нейтрализация кислоты. Выжидают около 10 мин для уравнивания температуры всех частей калориметров. Включив секундомер и равномерно помешивая содержимое калориметров мешалкой, в течение четырех минут каждые 30 с фиксируют температуру обоих растворов. После этого, не выключая секундомер, быстро вынимают пробирку с раствором щелочи из калориметра, приливают щелочь к находящемуся в другом калориметре раствору кислоты и интенсивно перемешивают содержимое. Через 2 мин после сливания растворов (с момента времени τ = 6 мин) вновь начинают производить снятие показаний термометра каждые 30 с ещё в течение 4 мин. Для расчета изменения температуры в процессе нейтрализации строят на миллиметровой бумаге график зависимости температуры от времени (рис. 1). Поскольку температуры растворов кислоты и щелочи в ходе предварительного периода измерялись разными термометрами, перед построением графика необходимо сравнить показания "кислотного" и "щелочного" термометров и при необходимости внести в величину температуры раствора щелочи поправку на разность показаний термометров (пересчитать температуру раствора щелочи на показания "кислотного" термометра).
Рисунок 1. Графическое определение изменения температуры
Термометры скрепляют друг с другом резинкой, закрепляют в штативе и помещают в стакан объемом 1 л, наполненный водой, температура которой должна быть примерно на 1 °С ниже, чем самая низкая из температур кислоты и щелочи до их сливания. При постоянном перемешивании с помощью магнитной мешалки воду нагревают со скоростью нагрева около 0.1 град/мин; при этом через каждую 1 мин фиксируют показания обоих термометров. Сравнение термометров проводится до температуры, приблизительно на 1 °С превышающей самую высокую температуру, зарегистрированную в ходе калориметрического процесса.
Температуру кислоты и щелочи на момент сливания определяют графически, экстраполируя зависимости температур от времени в ходе предварительного периода на середину главного периода (τ = 5 мин). Если растворы кислоты и щелочи в момент сливания имели разные температуры, за начальную температуру опыта принимают вычисленную по правилу аддитивности температуру t1, которая установилась бы при смешении растворов кислоты и щелочи, если бы смешение не сопровождалось тепловым эффектом:
Конечную температуру опыта t2 находят обычным образом, экстраполируя на середину главного периода зависимость температуры от времени в ходе заключительного периода. Молярную теплоту нейтрализации кислоты щелочью рассчитывают по уравнению (2):
Здесь К – постоянная калориметра, кал/град;
Здесь ΔНэксп и ΔНтабл – экспериментально найденная и табличная величины удельной теплоты растворения соли соответственно.
Расчет предельной относительной погрешности метода δ(ΔН)п проводится по уравнению (4); величина δКп определена в работе 1.
Здесь Vк – объем раствора кислоты; № 1. Калориметрическое определение теплоты растворения № 2. Калориметрическое определение теплоты нейтрализации № 3. Изучение равновесия гомогенной химической реакции в растворе № 4. Градуировка термопары № 5. Построение диаграммы плавкости двухкомпонентной системы № 6. Определения коэффициента распределения вещества между двумя жидкими фазами № 7. Изучение равновесия жидкий раствор – пар в бинарных системах № 8. Определение молекулярной массы растворенного вещества криоскопическим методом № 9. Определение степени диссоциации электролита криоскопическим методом № 10. Определение константы скорости гидролиза сахарозы № 11. Определение константы скорости и энергии активации реакции иодирования ацетона № 12. Определение константы скорости и энергии активации реакции гидролиза уксусного ангидрида № 13. Определение молярной рефракции вещества © Кафедра физической и коллоидной химии ЮФУ (РГУ) |
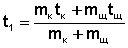 (1)
(1)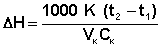 (2)
(2)