|
ПРАКТИКУМ ПО ФИЗИЧЕСКОЙ ХИМИИ для студентов химического факультета Работа № 11 Задания к работе 1. Изучить кинетику реакции иодирования ацетона методом отбора проб при двух температурах. 2. Построить кинетические кривые реакции. 3. Определить графическим и аналитическим методами среднюю константу скорости реакции при каждой температуре. 4. Рассчитать температурный коэффициент константы скорости и энергию активации реакции.
Реакция иодирования ацетона протекает в соответствии с уравнением:
Эта реакция катализируется кислотами; поскольку одним из продуктов является иодоводородная кислота, по мере протекания реакции её скорость возрастает (автокаталитическая реакция). Реакция иодирования ацетона не является элементарной и протекает в две стадии: 1. Катализируемая ионами водорода енолизация ацетона:
2. Взаимодействие иода с енольной формой:
Скоростьопределяющей (лимитирующей) в данном случае является первая стадия, поэтому скорость реакции зависит от концентрации ацетона и ионов водорода, но не зависит от концентрации иода:
Выражение для константы скорости реакции иодирования ацетона имеет следующий вид:
где СА – начальная концентрация ацетона, моль/л;
Два термостата устанавливают на заданные температуры (не ниже 25 °С, поскольку при более низких температурах реакция протекает слишком медленно). В мерную колбу на 250 мл наливают 25 мл 0.1 н раствора иода в 4 % растворе иодида калия, добавляют 25 мл 1 н раствора соляной кислоты и 160-170 мл воды (не доводя уровень раствора в мерной колбе примерно на 5 см). Колбу помещают в термостат; одновременно в термостат помещают другую колбу с дистиллированной водой. В коническую колбу на 25 мл с притёртой пробкой наливают 10 мл дистиллированной воды и взвешивают на аналитических весах. Затем в колбу с помощью пипетки вносят 1-1.5 мл ацетона, плотно закрывают пробкой, вновь взвешивают и рассчитывают массу ацетона. После взвешивания колбу помещают в термостат и выдерживают 10-15 минут. После установления заданной температуры раствор ацетона выливают в мерную колбу с подкисленным раствором иода, дважды ополаскивают небольшими порциями дистиллированной воды, помещённой ранее в термостат, и доводят объём раствора в мерной колбе до метки. Содержимое колбы быстро перемешивают и тотчас отбирают пипеткой пробу объёмом 25 мл, которую выливают в заранее приготовленную колбу для титрования, содержащую 25 мл 0.1 н раствора гидрокарбоната натрия. Время отбора первой пробы принимают за время начала реакции. Отобранную пробу титруют 0.01 н раствором тиосульфата натрия, используя крахмал в качестве индикатора (раствор крахмала добавляют в колбу для титрования, когда окраска титруемого раствора изменится до соломенно-жёлтой). В течение опыта необходимо отобрать 6-8 проб, первые три через каждые 10 минут, последующие через 15-20 минут. Изменение концентрации ацетона ΔСA за время, прошедшее от начала опыта, рассчитывают по формуле (3)
где Vo – объём раствора тиосульфата, пошедший на титрование первой пробы, мл;
Параллельно описанному опыту проводят второй аналогичный опыт при другой температуре, отличающейся на 5-15 °С, и также рассчитывают среднее значение константы скорости. Используя средние значения констант скорости реакции иодирования ацетона при двух различных температурах, находят по формуле (4) величину энергии активации реакции:
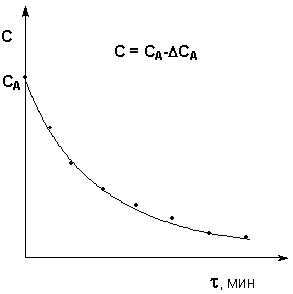
Рисунок 1. Кинетическая кривая реакции иодирования ацетона № 1. Калориметрическое определение теплоты растворения № 2. Калориметрическое определение теплоты нейтрализации № 3. Изучение равновесия гомогенной химической реакции в растворе № 4. Градуировка термопары № 5. Построение диаграммы плавкости двухкомпонентной системы № 6. Определения коэффициента распределения вещества между двумя жидкими фазами № 7. Изучение равновесия жидкий раствор – пар в бинарных системах № 8. Определение молекулярной массы растворенного вещества криоскопическим методом № 9. Определение степени диссоциации электролита криоскопическим методом № 10. Определение константы скорости гидролиза сахарозы № 11. Определение константы скорости и энергии активации реакции иодирования ацетона № 12. Определение константы скорости и энергии активации реакции гидролиза уксусного ангидрида № 13. Определение молярной рефракции вещества © Кафедра физической и коллоидной химии ЮФУ (РГУ) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||

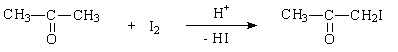

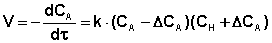 (1)
(1)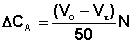 (3)
(3)