|
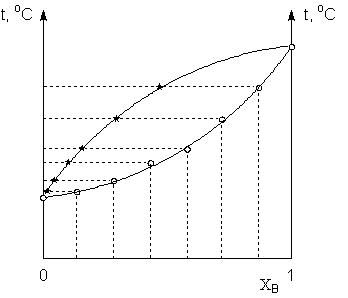
ПРАКТИКУМ ПО ФИЗИЧЕСКОЙ ХИМИИ для студентов химического факультета Работа № 7 Задания к работе 1. Определить на приборе Свентославского температуры кипения двух неограниченно смешивающихся органических растворителей и их смесей различных концентраций (по указанию преподавателя); отобрать пробы конденсата. 2. Определить показатели преломления чистых веществ, исходных растворов и проб конденсата. 3. Построить калибровочный график зависимости показателя преломления от состава раствора и с его помощью определить состав проб конденсата. 4. Построить диаграмму температура кипения – состав жидкости и равновесного пара; сделать вывод о наличии либо отсутствии отклонений от закона Рауля для изученной системы. В случае наличия экстремума на кривой состав – температура кипения определить состав азеотропной смеси.
Целью данной работы является построение диаграммы равновесия жидкость – пар в координатах состав – температура кипения при атмосферном давлении для бинарной системы, состоящей из неограниченно смешивающихся жидкостей. Для этого следует: а) приготовить растворы заданных концентраций в необходимых количествах; б) определить температуры кипения чистых компонентов и растворов при атмосферном давлении; в) определить состав пара, находящегося при температуре кипения в равновесии с каждым из растворов.
В сухих колбах с притёртыми пробками приготавливают по 15 мл растворов шести различных концентраций, смешивая отмеренные с помощью пипетки количества каких-либо органических растворителей (по указанию преподавателя или лаборанта). Колбы с растворами следует держать плотно закрытыми. Объёмы компонентов, используемые для приготовления растворов, указаны в таблице 1, в которую впоследствии заносятся и все полученные экспериментальные данные.
Здесь
WB – объёмная доля компонента В соответственно в растворе и
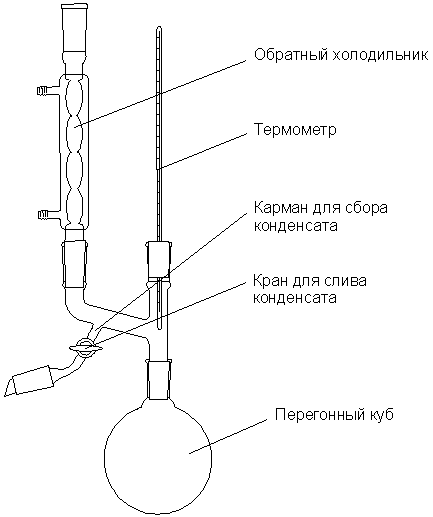
конденсате; Определение температур кипения и отбор проб конденсата осуществляется с использованием прибора Свентославского. Схема прибора приведена на рис. 1. Внимание! При выполнении работы используется открытое пламя! Работу надлежит выполнять только под тягой с соблюдением всех необходимых мер безопасности! Рисунок 1. Прибор Свентославского
Кубовой остаток сливают под тягой в специально отведённую склянку, прибор тщательно продувают воздухом для удаления остатков жидкости. После этого приступают к следующему опыту.
Состав собранного конденсата, который принимают равным составу равновесного пара при температуре кипения раствора, определяют рефрактометрическим методом. Показатель преломления раствора линейно зависит от его концентрации, выраженной в объемных долях W.
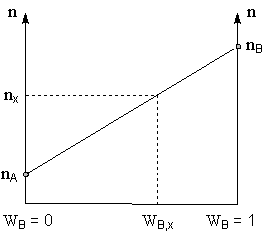
Определение состава конденсата производится по калибровочному графику. Для его построения измеряют показатели преломления чистых компонентов А и В (или, если нет уверенности в чистоте исходных растворителей, для конденсата, собранного при определении температур их кипения) и проводят на графике зависимости показателя преломления n от объёмной доли WВ компонента В прямую, соединяющую полученные значения (рис. 2).
Рисунок 2. Калибровочный график зависимости
Полученные данные позволяют построить диаграмму состояния системы в координатах температура – состав, выраженный в объёмных долях. Однако на практике, как правило, используются диаграммы состояния, в которых состав системы выражен в мольных долях. Поэтому для построения диаграммы состояния системы необходимо пересчитать содержание компонента В из объёмной доли WB в мольную долю XB по формуле (2):
Здесь МА и МВ – молярная масса компонента А и В соответственно;
Рисунок 3. Построение диаграммы состояния системы
№ 1. Калориметрическое определение теплоты растворения № 2. Калориметрическое определение теплоты нейтрализации № 3. Изучение равновесия гомогенной химической реакции в растворе № 4. Градуировка термопары № 5. Построение диаграммы плавкости двухкомпонентной системы № 6. Определения коэффициента распределения вещества между двумя жидкими фазами № 7. Изучение равновесия жидкий раствор – пар в бинарных системах № 8. Определение молекулярной массы растворенного вещества криоскопическим методом № 9. Определение степени диссоциации электролита криоскопическим методом № 10. Определение константы скорости гидролиза сахарозы № 11. Определение константы скорости и энергии активации реакции иодирования ацетона № 12. Определение константы скорости и энергии активации реакции гидролиза уксусного ангидрида № 13. Определение молярной рефракции вещества © Кафедра физической и коллоидной химии ЮФУ (РГУ) |

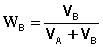 (1)
(1)
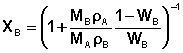 (2)
(2)