|
ПРАКТИКУМ ПО ФИЗИЧЕСКОЙ ХИМИИ для студентов химического факультета Работа № 10 Задания к работе 1. Изучить кинетику реакции гидролиза сахарозы поляриметрическим методом при двух различных концентрациях катализатора (ионов водорода). 2. Определить графическим и аналитическим методами среднюю константу скорости реакции. 3. Сделать вывод о влиянии концентрации катализатора на скорость реакции. Описание работы Процесс гидролиза сахарозы является элементарной бимолекулярной реакцией: C12H22O11 (сахароза) + H2O ––> C6H12O6 (глюкоза) + C6H12O6 (фруктоза) Кинетическое уравнение данной реакции в общем случае является уравнением второго порядка:
Здесь Ссах и Свод – концентрации сахарозы и воды соответственно;
Таким образом, в данном случае скорость реакции гидролиза сахарозы прямо пропорционально концентрации сахарозы в растворе. Поскольку в нейтральной среде скорость реакции очень мала, она проводится в присутствии кислоты; ионы водорода выступают в роли катализатора. Концентрация ионов водорода, не изменяющаяся в ходе реакции, также может быть включена в константу скорости реакции. В задачу данной работы, помимо определения константы скорости реакции гидролиза сахарозы входит также и изучение её зависимости от концентрации катализатора. Логарифм концентрации сахарозы в нашем случае линейно зависит от времени:
где Со и С – исходная концентрация сахарозы и её концентрация в момент времени τ соответственно. Для контроля за протеканием реакции в данной работе используется один из оптических методов исследования – поляриметрический. Применение его для изучения кинетики процесса гидролиза сахарозы возможно благодаря тому, что и сахароза, и продукты гидролиза – глюкоза и фруктоза – являются оптически активными веществами, и их водные растворы вращают плоскость поляризации поляризованного света. Угол вращения плоскости поляризации α прямо пропорционален концентрации оптически активного вещества C (в г/мл) и толщине слоя d (в см): α = А·C·d (5) Коэффициент пропорциональности a есть удельное вращение (или постоянная поляризации), которое зависит от природы вещества, длины волны поляризованного света, температуры и природы растворителя. Удельное вращение численно равно углу поворота плоскости поляризации света, прошедшего через слой толщиной 10 см раствора, содержащего 1 г вещества в 1 мл раствора и длине волны света, равной 589.6 нм (D-линия натрия). В ходе реакции гидролиза сахарозы угол вращения раствором плоскости поляризации изменяется, поскольку сахароза является правовращающим веществом (А = 66.55°), а эквимолярная смесь глюкозы (А = 52.50°) и фруктозы (А = – 91.90°) вращает плоскость поляризации света влево. Угол вращения плоскости поляризации света раствором, в начале реакции положительный, по мере её протекания уменьшается, стремясь к некоторому отрицательному конечному значению (т.е. происходит оптическая инверсия). Окончанию реакции соответствует некоторое предельное отрицательное значение угла вращения αоо. В уравнения (49) и (50) вместо значений концентраций сахарозы можно подставить разности соответствующих углов вращения плоскости поляризации света реакционной смесью. Тогда формулы (49) и (50) приобретают следующий вид:
Здесь αо – угол вращения плоскости поляризации света раствором в начальный
Приготавливают 100 мл раствора сахарозы в дистиллированной воде указанной преподавателем концентрации (примерно 15 – 20 масс. % сахарозы), для чего навеску сахарозы растворяют в заведомо меньшем количестве воды, а затем объём раствора доводят в мерной колбе до 100 мл. Две отобранные пипеткой пробы приготовленного раствора объёмом 25 мл переносят в пронумерованные конические колбы. К первой пробе добавляют 25 мл раствора кислоты, полученную смесь перемешивают, помещают в поляриметрическую трубку и производят измерение угла вращения плоскости поляризации приготовленным раствором (промежуток времени от момента добавления кислоты до измерения должен быть как можно меньшим). Полученное значение принимают за начальный угол вращения αо; от момента первого измерения начинают отсчёт времени реакции. После этого аналогичные операции производят со второй пробой (во втором опыте используют раствор кислоты другой концентрации). Измерение угла вращения плоскости поляризации производят через каждые 10 минут до тех пор, пока угол вращения не станет отрицательным (не менее 10 определений). Оставшуюся в одной из колб после заполнения поляриметрической трубки смесь растворов сахарозы и кислоты используют для определения конечного угла вращения αоо. Для этого смесь помещают на час в термостат с температурой 60 °С (обязательно используют обратный холодильник!). Затем смесь охлаждают до комнатной температуры и, после завершения наблюдений за изменением угла вращения в одном из опытов, помещают её в поляриметрическую трубку и производят измерение конечного угла вращения плоскости поляризации αоо. Поскольку исходная концентрация сахарозы в обоих опытах одинакова, достаточно определить конечный угол вращения для одной смеси. Все полученные в ходе работы экспериментальные данные заносят в таблицу 1. По формуле (7) рассчитывают константу скорости k для каждого момента времени реакции инверсии сахарозы; вычисляют среднее значение константы скорости kср.
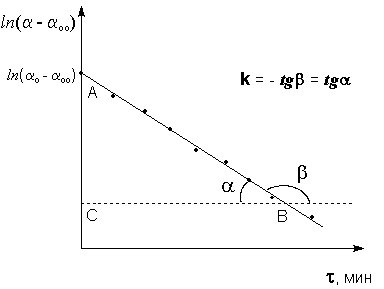
Среднюю константу скорости определяют также графически; для этого строят график в координатах τ – ln(α-αоо), как показано на рисунке 1. Данная зависимость является линейной. Константу скорости реакции инверсии сахарозы определяют по графику как тангенс угла наклона прямой к оси времени (отношение длин противолежащего |AC| и прилежащего |BC| катетов треугольника АВС; длины катетов берутся в единицах масштаба соответствующей оси координат). Рисунок 1. Графическое определение константы скорости инверсии сахарозы № 1. Калориметрическое определение теплоты растворения № 2. Калориметрическое определение теплоты нейтрализации № 3. Изучение равновесия гомогенной химической реакции в растворе № 4. Градуировка термопары № 5. Построение диаграммы плавкости двухкомпонентной системы № 6. Определения коэффициента распределения вещества между двумя жидкими фазами № 7. Изучение равновесия жидкий раствор – пар в бинарных системах № 8. Определение молекулярной массы растворенного вещества криоскопическим методом № 9. Определение степени диссоциации электролита криоскопическим методом № 10. Определение константы скорости гидролиза сахарозы № 11. Определение константы скорости и энергии активации реакции иодирования ацетона № 12. Определение константы скорости и энергии активации реакции гидролиза уксусного ангидрида № 13. Определение молярной рефракции вещества © Кафедра физической и коллоидной химии ЮФУ (РГУ) |