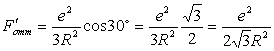|
ТЕОРИЯ СТРОЕНИЯ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ Курс лекций для студентов химфака ЮФУ (РГУ) ПРИРОДА СИЛ КОМПЛЕКСООБРАЗОВАНИЯ О природе сил комплексообразования – Электростатические представления – Энергия комплексного иона – Критерий Ламберта – Ион-дипольное взаимодействие Электростатические представления в координационной химии Итак, связь, возникающая за счет полного переноса электрона от одного атома к другому, называется ионной или электростатической. Важное допущение в простой электростатической модели состоит в том. Что при образовании ионной связи, то есть при электростатическом взаимодействии ионов, они не теряют своей индивидуальности и не подвергаются деформации, то есть радиус свободного иона одинаков (равен) с радиусом иона в электростатическом комплексе. Отметим, что в электростатическое взаимодействие включены следующие виды: ▪ Ион-ионное (монополь-монополь) ▪ Ион-дипольное, то есть, когда ион взаимодействуетс нейтральной молекулой, имеющей постоянный дипольный момент. ▪ Диполь-дипольное, то есть взаимодействие между молекулами, имеющими постоянный дипольный момент. ▪ Взаимодействие типа диполь-индуцированный (наведенный) диполь. ▪ Дисперсионное взаимодействие. Если считать, что в парах молекула, например CsCl мономерна и образуется из двух нейтральных атомов, то схему образования в ней ионной связи можно представить таким образом: Cs0 (газ) – 1е = Сs+ (газ) – E1 Cl0 (газ) + 1е = Сl- (газ) + E2 ; Сs+ (газ) + Сl- (газ) = Сs+Сl- (газ) + E3 E1 = Eионизации = -89.4 ккал/моль E2 = Eсродства к электрону = 86.5 ккал/моль E3 – энергия электростатического притяжения ионов. Просуммировав уравнения получим: Cs0 (газ) + Cl0 (газ) = Сs+Сl- (газ) + Q; Здесь Q это энергия образования молекулы Сs+Сl- из атомов. Q = E1 + E2 +E3 Данная сумма показывает соотношение теплоты образования комплекса (Q) и энергией электростатического притяжения (E3). Однако эта формула не описывает образование более сложных частиц [CsCl2]-1, [CsCl3]-2, то есть комплексных ионов. Поэтому проанализируем энергию и силы комплексообразования более подробно. Ко всем силам ( в том числе и к силам электростатического взаимодействия в комплексе) применим второй закон Ньютона:
V.dV.m = F.dx mVdV – Fdx = 0 Проинтегрируем все силы и получим общую энергию (так как энергия – сумма всех сил действующих в системе на интервале от какого-то предельного расстояния до бесконечности).
Для молекулы, состоящей из двух однозарядных частиц:
Здесь r = r+ + r- От полного слияния ионов их удерживает сила взаимного отталкивания. Эти силы также носят электростатическую природу (взаимное отталкивание ядер атомов (ионов)) и электронных оболочек и могут быть описаны только в рамках квантовой механики, но не в рамках классической электродинамики. Однако из экспериментальных данных известно, что
В положении равновесия Fпритяжения = - Fотталкивания . Так как
Тогда Для одной молекулы: Uобщ = Uприт + Uотт
Для одного моля умножим правую часть на N – число Авогадро.
Если же заряды ионов равны Z1 и Z2 , то
Теперь можно получить окончательное выражение для теплоты образования комплекса Рисунок 4. Зависимость Энергии комплекса от межионного раcстояния.
Разрешая относительно r0 находим (имея значения энергии ионизации для цезия, сродства к электрону для хлора, заряды ионов (+1, -1), заряд электрона и n), что r0 ≤ 115 A. То есть, начиная с расстояния 115 А два противоиона будут стягиваться в комплекс. Это условие выполняется для многих солеобразных соединений. Поэтому соли типа NaCl могут существовать в газовой фазе в виде отдельных молекул. Важно отметить, что характерной особенностью ионной связи является ее ненасыщенность. То есть минимуму потенциальной энергии не соответ-ствует случай взаимодействия одного k-зарядного катиона (+) и одного же k-зарядного аниона (-). Далее это будет подтверждено расчетами. Особенность образования ионной связи состоит в изменении размеров атомов при их ионизации. Причем, такое изменение антибатно для случаев присоединения или отрыва электрона:
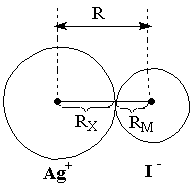
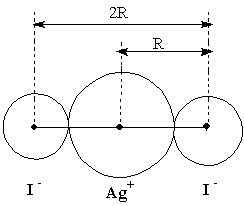
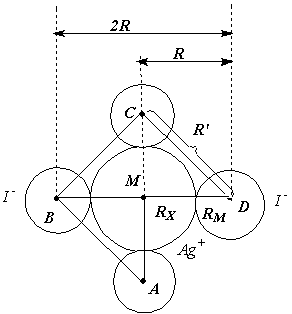
Это явление обусловлено сжимаемостью электронных орбиталей по мере роста заряда иона и приводит к усилению степени ненасыщенности ионной связи. Поскольку потенциал поля катиона больше, чем соответствующий потенциал для аниона (так как эффективный заряд равен q = q/r), то потенциал отрицательного поля не может полностью скомпенсировать потенциал положительного поля и к одному катиону могут притягиваться несколько отрицательных. Подкрепим эти рассуждения расчетами. Для этого рассмотрим баланс сил притяжения и отталкивания в системах. Содержащих один ион Ag+ и разное количество однозарядных анионов (I-). В качестве критерия для оценки какая из сил преобладает, можно воспользоваться двумя значениями: ▪ Сумма всех сил притяжения и отталкивания в комплексе, которая должна быть отрицательной для устойчивых структур (поскольку сила притяжения, найденная по закону Кулона отрицательна). ▪ Отношение суммы сил притяжения к сумме сил отталкивания (SP = Воспользуемся в наших расчетах вторым критерием, то есть для устойчивого комплекса: SP = Однако, поскольку мы не учитываем дисперсионных сил отталкивания примем, что для устойчивых комплексов: SP = Так как мы будем рассматривать комплексы, содержащие одинаковые анионы с симметричным расположением, то можно ограничиться рассмот-рением баланса сил вдоль одной координационной связи: SP = И так, рассмотрим взаимодействие одного однозарядного катиона (например Ag+) с несколькими однозарядными анионами (например, I-). При этом возможны различные координационные числа (N= 1, 2, 3, 4 и т.д.). К рассмотрению стоит принимать только симметричные структуры (то есть с симметричным расположением лигандов). В таких комплексных ионах будет последовательно изменяться общий заряд и баланс сил. Сумму радиусов аниона и катиона обозначим за R. В такой частице сил отталкивания нет. Строго говоря, здесь есть дисперсионные силы, о которых говорилось выше.
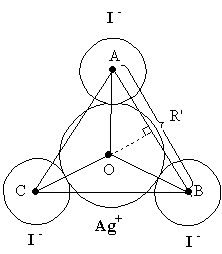
То есть координационное число 2 возможно и ион [AgI2]- будет устойчив. Рассмотрим трехкоординированный ион [AgI3]2-. Анионы образуют вершины равностороннего треугольника.
Из треугольника BOA найдем R’:
Мы нашли силу отталкивания вдоль линии, соединяющей анионы. Вклад этой силы в координационную связь будет равен ее проекции на эту связь
С учетом того, что таких связей две общий вклад составит: И тогда:
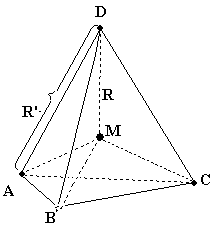
Значит такое координационное число также возможно при взаимодействии однозарядного катиона с однозарядными анионами. При координационном числе 4 возможны две симметричных структуры – плоский квадрат и тетраэдр. Рассмотрим обе из них.
Из треугольника DBC найдем R’:
Общая сила отталкивания, действующая на связь, складывается из силы, действующей вдоль линии АС, и совпадающей с ней, и двух проекций сил, действующих вдоль линии АВ (или АD). Тогда:
То есть, при координационном числе 4 и плоско-квадратном окружении центрального иона координационное соединение не образуется (при заряде центрального иона +1, для других случаев см. ниже). Рассмотрим тот же случай, для тетраэдрического окружения центрального иона. В данном случае силы притяжения, действующие вдоль линии связи, будут теми же, а суммарная сила отталкивания определяется суммой трех одинаковых проекций сил отталкивания, действующих вдоль линий, соединяющих анионы, лежащие в вершинах тетраэдра.
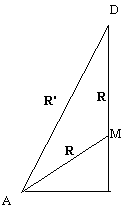
Найдем |AB| = |AC| = |AD| = R’ из треугольника АВМ, учитывая, что угол между осями тетраэдра
То есть, такая структура также скорее всего не устойчива, но более вероятна, чем структура с плоско-квадратным окружением центрального иона и, если (при определенных условиях) такой ион как [AgI4]-3 может образоваться, то он будет иметь тетраэдрическое строение. При возрастании заряда центрального иона, к примеру, до величины +2, сила притяжения в соответствии с законом Кулона возрастет в два раза:
При этом силы притяжения останутся неизменными (по сравнению с рассмотренным выше случаем однозарядного катиона), поскольку взаимодействие анионов дает только отрицательный вклад в общую устойчивость комплекса. Тогда для плоско-квадратной структуры:
А для тетраэдрической:
Таким образом, обе структуры уже будут устойчивы, причем значения баланса сил близки, из чего можно предположить существование в растворе равновесия между этими двумя координационными ионами. Подобные расчеты были сделаны сначала Косселем (для комплексов с ионами) и в последствие Маделунгом (для комплексов с нейтральными молекулами). Их расчеты были несколько сложнее, так как они использовали некоторые поправки, но общий принцип расчет остается тем же. Результаты расчетов сведены в таблице 7. Таблица 7. Баланс сил для комплексов с однозарядными анионами.
Следует иметь в виду, что расчеты приведены для условий, когда отсутствуют дополнительные колебания частиц под действием температуры, что оказывает дополнительный дестабилизирующий эффект и понижает граничное значение Sp приблизительно до 0.8. Представленные расчеты позволяют сделать следующие выводы. 1. Ионная связь является ненасыщенной, поскольку минимуму потенциальной энергии должно отвечать не взаимодействие одного k-зарядного катиона с одним же k-зарядным анионом, а взаимодействие одного k-зарядного катиона с несколькими k-зарядными анионами. Количество этих анионов в таком комплексе можно рассматривать как максимальное координационное число. 2. Координационное число зависит от соотношения зарядов катиона и анионов. При однозарядных анионах КЧ однозарядных катионов равно 3, для двухзарядных 5 – 6, для трехзарядных 7 – 8. 3. Показана большая термодинамическая устойчивость комплексов с пространственной упаковкой (тетраэдр, октаэдр) по сравнению с плоскими (квадрат, шестиугольник). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
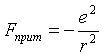
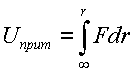
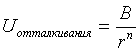 , где
, где 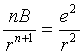
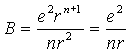
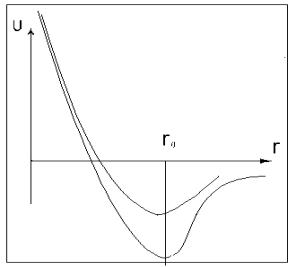
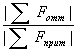 ), которая должна быть меньше единицы.
), которая должна быть меньше единицы.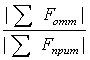 <1
<1 < 0.9
< 0.9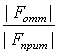 < 0.9
< 0.9