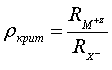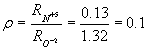|
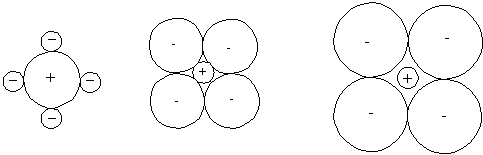
ТЕОРИЯ СТРОЕНИЯ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ Курс лекций для студентов химфака ЮФУ (РГУ) ПРИРОДА СИЛ КОМПЛЕКСООБРАЗОВАНИЯ О природе сил комплексообразования – Электростатические представления – Энергия комплексного иона – Критерий Ламберта – Ион-дипольное взаимодействие Критерий Ламберта (критическое отношение радиусов) В отличие от ковалентной связи, характеризуемой насыщенностью и направленностью ионная связь не направлена. То есть ионы, обладая зарядом, притягиваются только результате действия электростатических сил (в соответствии с законом Кулона) не зависимо от их пространственного положения. В связи с этим, геометрическая структура комплексных соединений с таким типом связывания определяется только геометрическими параметрами – размером лигандов и центрального иона. А также их соотношением. (Ковалентные силы и тип гибридизации атомов не участвую в организации той или иной структуры). В связи с этим приведенные расчеты справедливы только для случая, когда выполняется условие: R = RM + RX Такое условие выполнимо не всегда. При малом радиусе аниона и большом для катиона это условие, скоре всего, выполнимо, в противном случае оно может не выполняться. Следовательно, существует граничный случай соотношения размеров катиона и аниона. Рассмотрим возможные структуры, например, для плоско-квадратного окружения (или для октаэдрического) (рис. 5). Рисунок 5. Отношение радиусов в плоско-квадратных структурах.
(А) ρ > ρкрит. (B) ρ = ρкрит (C) ρ <ρкрит В случае (С) электростатические силы все равно работают, но для выяснения баланса сил приведенная выше схема не работает, т.к. R ≠ RM + RX Для установления структуры комплексных ионов было выведено
При критическом соотношении радиусов анионы не только вплотную прилегают к катиону (ионы рассматриваются как упругие шары не подверженные деформациям), но и друг к другу. Ясно, что для случаев А, В, С силы отталкивания возрастают, а силы притягивания ослабевают. Таким образом критерий устойчивости комплексного иона: ρ ≥ ρкрит (критерий Ламберта) Структуру (В) считаем критической, ибо для нее ρ = ρкрит. Рассмотрим ее и найдем ρкрит. (Структура В (рис. 6) является пределом устойчивости для комплексного иона КЧ = 6 (октаэдр) либо для КЧ = 4 (плоский квадрат). Для нее ρ = ρкрит. Воспользуемся ею и найдем ρкрит. (Структура В является пределом устойчивости для комплексного иона КЧ = 6 (октаэдр) либо для КЧ = 4 (плоский квадрат). Рисунок 6. Критический случай отношения радиусов ионов Из прямоугольного треугольника АВС можно найти: |AB| = RM |AC| = RM + RX RX = (RM +
RX).соs
45° = (RM +
RX) поделим обе части на RX :
Это соотношение было впервые найдено Ламбертом. Аналогичным простым способом можно выявить критическое соотношение радиусов и для других геометрических структур. В ряде случаев экспериментальные данные соответствуют результатам этих простых расчетов. Таблица 8. Отношение радиусов для некоторых соединений.
Ламберт нашел отношение критических радиусов для комплексов с различными значениями КЧ и различным пространственным строением: Таблица 9. Критическое отношение радиусов для различных структур.
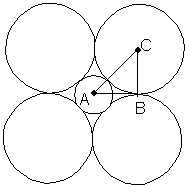
Воспользовавшись значениями ρ можно объяснить существование многих комплексных ионов и невозможность существования других. Так отношение ρ для ионов Si+4 и F- , равное 0.29, занимает промежуточное значение между ρ тетраэдра и квадрата (0,22 и 0,44). Комплекс [SiF6]-2 встречается, а SiCl6 – нет (ρ=0,22 , т.е. соотношение радиусов меньше критического). Таким же образом можно объяснить существование ионов [PO4]3- , [TeO6]6- и отсутствие [NO4]- и [SO6]6-
Т.е. структура NO3- (ρкрит= 0,15), возможна к существованию, правда она будет достаточно напряженной. Здесь, однако, необходимо учесть, что ионы построены не из ионов N+5, О-2, Р+5. При решении подобных задач, т.е. при нахождении ρ необходимо пользоваться так называемыми радиусами Гольдшмидта. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||