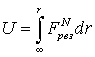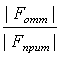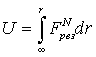|
ТЕОРИЯ СТРОЕНИЯ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ Курс лекций для студентов химфака ЮФУ (РГУ) ПРИРОДА СИЛ КОМПЛЕКСООБРАЗОВАНИЯ О природе сил комплексообразования – Электростатические представления – Энергия комплексного иона – Критерий Ламберта – Ион-дипольное взаимодействие Энергия комплексного иона Приведенные расчеты позволяют установить набор возможных координационных числе для данного иона. Для выяснения того, какое из них является наиболее характерным, необходимо рассчитать общую энергию комплексного иона.
Fрез = Fприт – Fотт , где FNрез – результирующая сила, действующая на N лигандов, Так как SP = Для z-зарядного катиона Fрез = Fприт –
Fотт =
U = – N(z–Sp)e2
Найдем значения потенциальной энергии для различных ионов: 1. z = +1, N = 1, Sp = 0 U = – 2. z = +1, N = 2, Sp = 0.25 U = – 1.5
3. z = +2, N = 2,
Sp = 0.25 U = – 3.76 Проделав такие вычисления для полного набора координационных чисел можно свести их в таблицу данных, показывающих зависимость потенциальной энергии комплекса от координационного числа центрального иона и его заряда z. Таблица 8. Энергия комплекса (в единицах –
Из таблицы видно, что при постоянном значении межионного расстояния энергия образования комплекса с увеличением количества лигандов (N, координационное число) сначала падает, а затем растет, принимая некоторое минимальное значение, которое соответствует наиболее стабильному состоянию, выгодному энергетически. Эти закономерности подтверждаются рядом экспериментальных данных. Так для одновалентных ионов Ag+, Cu+, Au+ характерны комплексные ионы состава [MX2]-. Для двухвалентных ионов (Zn+2, Cd+2, Be+2 и т.д.) наиболее характерным является координационное число 4. Однако, координационное число 6 для многих из двухвалентных ионов также может проявляться. Это объясняется тем, что в данном приближении не учитывается целый ряд факторов, влияющих на комплексообразование. Таким образом, если рассмотрение баланса сил притяжения и отталкивания в координационном ионе позволяет найти набор возможных для данного иона координационных чисел, то нахождение энергии комплекса указывает на наиболее вероятное (но, не единственно возможное) координационное число. То есть такой расчет дает возможность предположить, какие именно ионы будут присутствовать в растворе в наибольшем количестве и выделяться (кристаллизоваться) препаративно (в индивидуальном состоянии). |
||||||||||||||||||||||||||||||||||||||||||||||||